氯碱厂电解饱和食盐水制取NaOH的工艺流程如下:
(1)精制过程中反应的离子方程式为______.
(2)电解过程的总反应方程式为______.
(3)电解槽阳极产物可用于______(至少写出两种用途).
(4)已知NaOH、NaCl在水中的溶解度数据如下表:
| 温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| NaOH/g | 109 | 118 | 129 | 146 | 177 | 300 | 313 | 318 | 337 |
| NaCl/g | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
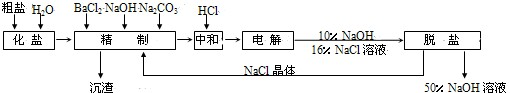
(1)精制过程中,加入氯化钡,可以将杂质离子硫酸根除去,即Ba2++SO42-=BaSO4↓,加入氢氧化钠,可以将杂质离子镁离子除去,即Mg2++2OH-=Mg(OH)2↓,加入碳酸铵,即可以将杂质钙离子除去,还可以将多余的钡离子除去,即Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓,
故答案为:Ba2++SO42-=BaSO4↓,Mg2++2OH-=Mg(OH)2↓,Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓;
(2)电解饱和食盐水可以获得三大工业原料:氢氧化钠、氢气、氯气,电解反应方程式为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑, 电解 .
故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑; 电解 .
(3)电解池中阳极是氯离子发生失电子的氧化反应生成氯气的过程,氯气的用途:制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料等,
故答案为:制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料等(任写2种);
(4)根据表中数据可以得出:氢氧化钠的溶解度随温度的升高而增大,但是氯化钠的溶解度受温度的影响不大,固始县氢氧化钠和氯化钠分离的方法是:蒸发浓缩结晶的过程,脱盐后的碱液中会含有氯化钠晶体,因为发过程中溶剂(水)大量减少,Na+浓度显著增加促进NaCl的沉淀溶解平衡向沉淀方向移动,
故答案为:蒸发;浓缩;蒸发过程中溶剂(水)大量减少,Na+浓度显著增加促进NaCl的沉淀溶解平衡向沉淀方向移动(或:Na+浓度显著增加抑止了NaCl的溶解).
