工业接触法制硫酸的流程如图所示:
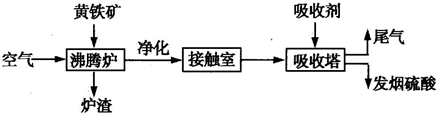
(1)写出沸腾炉中发生反应的化学方程式:______.
(2)从沸腾炉出来的气体经净化干燥处理后进入接触室,其气体体积组成:SO2 7%,O2 11%,N2 82%.从接触室出来的气体中SO3 的体积分数为7%,则SO2的转化率为______.
(3)接触室采用常压而不采用高压的原因是______.
(4)在吸收塔中用98.3%的浓硫酸吸收SO3 ,而不是用水吸收SO3 的原因是______.
每100g SO3 与H2O完全反应放出热量162.9kJ,该反应的热化学方程式为______.
(5)某硫酸厂每天用含FeS2 60%的黄铁矿500t生产硫酸,如果在沸腾炉内损失5%的硫,SO2 的转化率为90%.每天能生产98%的硫酸______t.
(1)FeS2与O2在高温条件下生成Fe2O3和SO2,故答案为:4FeS2+11O2
2Fe2O3+8SO2; 高温 .
(2)设总体积为100
2SO2+O2=2SO3
初始 7 11 0
转化 x
x x1 2
平衡 7-x 11-
x x1 2
=7%x 7-x+11-
x+x+821 2
x=1400 207
转化率=
×100%=96.6%,故答案为:96.6%;x 7
(3)常压时SO2的转化率已经很高,采用高压对SO2的转化率提高不多,却会大大增加设备成本,故答案为:常压时SO2的转化率已经很高,采用高压对SO2的转化率提高不多,却会大大增加设备成本;
(4)△H=-
=-130.3KJ/mol,故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-130.3KJ/mol;162.9KJ×80g/mol 100g
(5)沸腾炉中损失5%的硫,SO2转化率为90%这些都可转化为S元素的损失,进而转化为FeS2的损失.所以设生产98%的硫酸x吨.则由关系式:
FeS2------------2H2SO4
120 2×98
500t×60%×(1-5%)×90% x×98%
解得 x=427.5t,
故答案为:427.5.

