工业“从海水中提取镁”的流程图如图所示: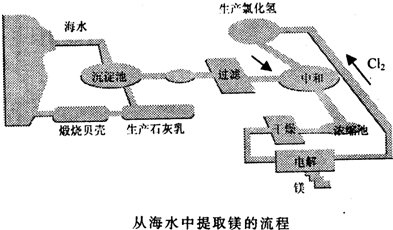
步骤为:
①将海边大量的贝壳煅烧成生石灰,并将生石灰制成石灰乳;
②将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
③在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2•6H2O;
④将MgCl2•6H2O在一定条件下加热得到无水MgCl2;
⑤电解熔融的氯化镁可得到Mg.
(1)步骤①中涉及的化学方程式为______.
(2)步骤③中的蒸发利用风吹日晒完成,但在实验室中蒸发操作时需要的主要仪器有______、______、酒精灯、三角架等.
(3)海水中的镁以Mg抖形式存在,设计步骤②③将Mg2+转化为Mg(OH)2又重新转化为Mg2+的目的是______.
(4)步骤④中的“一定条件”指的是______,目的是______.
(5)上述流程中,在降低成本、减少污染方面做了一些工作,请写出其中一点:
(6)有同学认为:可以在步骤②后加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,以简化实验步骤,体现实验的简约性原则.你是否同意该同学的观点______(填“同意”或“不同意”),理由为______.
(1)碳酸钙加热分解产生氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,方程式分别为:CaCO3
CaO+CO2↑(2分);CaO+H2O=Ca(OH)2;高温 .
故答案为:CaCO3
CaO+CO2↑;CaO+H2O=Ca(OH)2;高温 .
(2)蒸发过程所用到的仪器有蒸发皿、玻璃棒、酒精灯、三角架、坩埚钳等,
故答案为:蒸发皿,玻璃棒;
(3)海水中镁离子的浓度低,需要富集镁元素,提高Mg2+的浓度;
故答案为:提高Mg2+的浓度,起到富集的作用;
(4)MgCl2在加热时易水解生成氢氧化镁沉淀,此时应防止水解,则应在HCl氛围中,同时可以带走水蒸气;
故答案为:在HCl气流中;抑制MgCl2水解成Mg(OH)2;可以带走水蒸气;
(5)电解产生的Cl2用于制取HCl气体,实现盐酸循环利用,减少了环境污染,
故答案为:电解产生的Cl2用于制取HCl气体;
(6)MgO熔点远高于MgCl2,应注意节约能源,可用氯化镁代替.
故答案为:不同意;因为MgO熔点很高,熔融时耗费大量的能量增加生产成本.
