三(11)班学生将采集到的样品用水冲洗后晾干,获得了25.0g块状石灰石样品.班级甲、乙两组同学共利用这25.0g石灰石样品分别进行了如下实验.(假设样品中其他杂质不参加反应,不考虑水、氯化氢逸出)
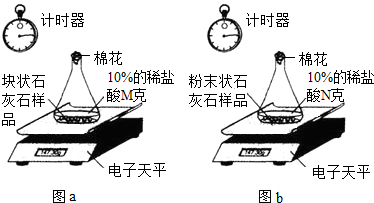
[实验过程]
甲组:取一定质量的块状石灰石样品于锥形瓶内,并加入10%的稀盐酸Mg,恰好完全反应.(如图a)
乙组:先把剩余的块状石灰石样品研碎成粉末状,然后全部置于锥形瓶内,并加入10%的稀盐酸Ng,也恰好完全反应.(如图b)
[数据处理]
(1)甲、乙两组同学所用稀盐酸的总质量:M+N=146g.
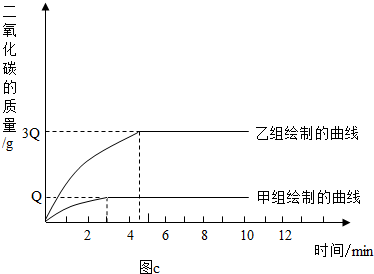
(2)两组同学经数据处理得到释放出二氧化碳的质量与反应时间的关系如下图c
[问题讨论]
(1)甲、乙两组同学的实验中,______组实验消耗的时间更短.
(2)图c中的数据Q等于______g,甲、乙两组实验中 * * 生二氧化碳气体______g,两次实验中消耗的稀盐酸质量比M:N=______.
(3)求石灰石样品中碳酸钙的质量分数.
解;(1)由数据图可知,甲组同学在3分钟时,反应已完全,而已组同学在4分多的时候反应才完全.
故答案为:甲.
(2)设甲、乙两组同学的实验中共生成二氧化碳的质量为x,参与反应的CaCO3质量为y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
y 146×10% x
∴
=73 44
,146×10% x
=100 73 y 146×10%
解之得:x=8.8g,y=20g
由图c可知,甲、乙两组同学的实验中生成的气体之比为1:3,
故甲组同学的实验中生成气体的质量Q为:8.8g×
=2.2g,1 3+1
故答案为:2.2、8.8、1:3.
(3)由(2)可知,参与反应的CaCO3质量为20g,
故石灰石样品中碳酸钙的质量分数为:
×100%=80%20 25
答:石灰石样品中碳酸钙的质量分数为80%.
