Ⅰ、以原油为原料生产聚乙烯的步骤如下:

请回答:
(1)上述过程属于物理变化的是______(填序号).
(2)聚乙烯塑料可以用来制造多种包装材料,聚乙烯的结构简式是______.
(3)将11.2L(标准状况)乙烷和乙烯的混合气体通入足量的溴水中,充分反应后,溴水质量增加了5.6g.溴水质量增加的原因是(用化学方程式表示):______.
原混合气体中,乙烷与乙烯的物质的量之比是______.
Ⅱ、实验室用下图所示装置制取乙酸乙酯.请回答:
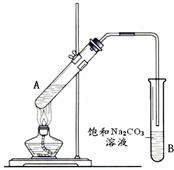
(1)在试管A中先加3mL乙醇,然后边振荡边加入2mL浓硫酸和2mL乙酸,它们之间发生反应的化学方程式为:
______.
(2)加热一段时间后,可以看到试管B的液面______(填“上”或“下”)有透明的、不溶于水的油状液体产生,并可以闻到香味.
(3)B试管中的导管不伸入液面下的原因是______(填序号).
①防止溶液倒吸②避免反应过快.
Ⅰ、(1)分馏过程中没有新物质生成,属于物理变化,故答案为:①;
(2)聚乙烯的结构简式: ,故答案为:
,故答案为: ;
;
(3)乙烯含有双键,能与溴水发生加成反应:CH2=CH2+Br2→CH2BrCH2Br;11.2L混合气体的物质的量为n=
=V Vm
=0.5mol,11.2L 22.4L/mol
乙烯含有双键,能与溴水发生加成反应,乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了5.6g,即为乙烯的质量,
所以乙烯的物质的量为n=
=m M
=0.2mol,5.6g 28g/mol
则乙烷的物质的量为:0.5mol-0.2mol=0.3mol,质量为:0.3mol×30g/mol=9g,
所以,乙烯与乙烷的物质的量之比为0.2mol:0.3mol=2:3,故答案为:CH2=CH2+Br2→CH2BrCH2Br;3:2;
Ⅱ、(1)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,同时该反应可逆,反应的化学方程式为
CH3COOH+CH3CH2OH
CH3COOC2H5+H2O;故答案为:CH3COOH+HOCH2CH3浓硫酸 △
CH3COOCH2CH3+H2O;浓硫酸 △
(2)CH3COOC2H5的密度比水的小,浮在水的上面,故答案为:上;
(3)乙醇和乙酸易溶于水,若伸入液面以下,可能发生倒吸,故答案为:①.
