目前,在研究新能源的前沿技术上,科学家致力于二氧化碳的“组合转化”技术的研究,把过多二氧化碳转化为有益于人类的物质.
(1)乙烯的产量是衡量一个国家石油化工发展水平的标志之一,下列石油化工生产能提高乙烯的产量的是:
A.蒸馏、分馏 B.催化裂化 C.催化裂解 D.催化重整
(2)下列说法不正确的是:
A.石油是混合物,分馏后的得到的馏分是纯净物
B.煤隔绝空气加强热可以得到黑褐色油状的煤焦油
C.煤的气化和液化是使煤变成清洁能源的有效途径
D.从绿色化学角度考虑,以植物为主的生物质资源,是未来的理想资源
(3)如果将CO2和H2以1:4的比例混合,通入反应器,在适当的条件下反应,可获得一种重要的能源.请完成以下化学方程式:CO2+4H2→______+2H2O
(4)若将CO2和H2以1:3的比例混合,使之发生反应生成某种重要的化工原料和水,该原料可能是
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
(5)甲、乙、丙三个化肥厂生产尿素所用的原料不同,但生产流程相同:
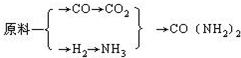
①甲厂以焦炭和水为原料;②乙厂以天然气和水为原料;③丙厂以石脑油(主要成分为C5H12)和水为原料.按工业有关规定,利用原料所制得的原料气H2和CO2的物质的量之比,若最接近合成尿素的原料气NH3(换算成H2的物质的量)和CO2的物质的量之比,则对原料的利用率最高.据此判断甲、乙、丙三个工厂哪个工厂对原料的利用率最高?______.
(6)请根据以上信息,设计工业合成尿素的条件______.
(1)A.石油分馏主要得到粗石油、轻油、煤油及重油等,故A错误; B.催化裂化以生产汽油、煤油和柴油等轻质油品的目的,故B错误;
C.催化裂解旨在生产乙烯、丙烯、丁烯、丁二烯等基本化工原料,故C正确;
D.催化重整主要是提高苯及其同系物就是所谓的芳香烃的产量,故D错误.
故选C;
(2)A.石油分馏主要得到粗石油、轻油、煤油及重油等,是混合物,故A错误;
B.煤隔绝空气加强热得到油状液体是煤焦油,故B正确;
C.煤的气化和液化能提高煤的燃烧效率,减少污染物的排放,故C正确;
D.以植物为主的生物质资源,无污染,是未来的理想资源,故D正确.
故选A;
(3)根据质量守恒定律的微观解释可以知道:反应前后的原子数目和种类应该相等,分析题给的化学反应方程式可以知道,反应前出现了2个O,1个C,8个H,反应后出现了2个O,4个H,所以在X中含有4个H和1个C,故答案为:CH4;
(4)由反应物CO2和H2混合在一定条件下以1:3(分子数比)比例发生反应,可判断混合气体中C、H原子个数比为1:6;又由于反应后生成水,即有H原子与O原子化合成水分子;而在四个选项中的物质中都不含O元素,可判断1个CO2分子中的2个O原子应与4个H原子结合成2个水分子,即混合气体中的1个C原子应与2个H原子化合成化工原料;
通过以上分析,可得出化工原料中C、H原子个数比应为1:2;而在CH4中C、H原子个数比为1:4,在C2H2中C、H原子个数比为1:1,在C2H4中C、H原子个数比为1:2,在C2H6中C、H原子个数比为1:3;故选B;
(5)NH3(换算成H2的物质的量)和CO2的物质的量之比为2:1合成尿素,即H2和CO2的物质的量之比为
:1=3:1.2×3 2
甲厂以焦炭和水为原料,C+2H2O
CO2+2H2,生成的H2和CO2的物质的量之比为2:1. 高温 .
乙厂以天然气和水为原料,CH4+2H2O
CO2+4H2,生成的H2和CO2的物质的量之比为2:1. 高温 .
丙厂以乙烯和水为原料,C2H4+4H2O
2CO2+6H2,生成的H2和CO2的物质的量之比为3:1, 高温 .
故答案为:丙;
(6)根据
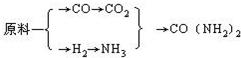
,正反应是物质的量减小的反应,故增大压强能减小使平衡向正反应方向移动,且反应速率增大,故合成尿素的条件:高压、催化剂、适宜的温度,
故答案为:高压、催化剂、适宜的温度;
