从海水中可以获得淡水、食盐,并可提取镁和溴等物质.
(一)海水淡化的方法主要有______(填一种).
(二)从海水中提取溴和镁的流程如图所示:
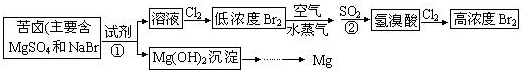
(1)提取Br2时,第一次通入Cl2后发生反应的离子方程式是______;②中SO2表现______(填“氧化”或“还原”)性;第二次通入Cl2后,要提取Br2还要进行的操作为______.
(2)为了实现对镁离子的富集,①中加入的足量试剂是______(填化学式);
试从节约能源,提高金属镁的纯度分析,以下最适宜的冶炼的方法是______(填字母).
A.Mg(OH)2
MgO△
Mg电解 2800℃
B.Mg(OH)2
MgO△
MgC、真空 1352℃
C.Mg(OH)2
无水MgCl2①过量盐酸 ②△
Mg电解 714℃
D.Mg(OH)2
MgCl2溶液盐酸
Mg.活泼金属
(一)淡化海水,应将水与海水中的盐进行分离,常用方法有蒸馏、电渗析以及离子交换法等,最简单的是蒸馏的方法,故答案为:蒸馏;
(二)向苦卤中加入试剂①得到Mg(OH)2,且不能引入新的杂质离子,则①应该是NaOH,Mg(OH)2溶于稀盐酸得到MgCl2溶液,将MgCl2.6H2O在HCl氛围中脱水得到MgCl2,电解熔融MgCl2得到Mg;
向溶液中通入过量Cl2,发生反应2Br-+Cl2=2Cl-+Br2,得到低浓度的Br2,用热空气将Br2吹出,然后用二氧化硫还原溴得到溴离子,反应方程式为SO2+2H2O+Br2=H2SO4+2HBr,向氢溴酸中通入氯气,发生反应2Br-+Cl2=2Cl-+Br2,从而得到高浓度的Br2,
(1)通过以上分析知,提取Br2时,第一次通入Cl2后发生反应的离子方程式是2Br-+Cl2=2Cl-+Br2;②中发生的反应为SO2+2H2O+Br2=H2SO4+2HBr,S元素化合价由+4价变为+6价,所以SO2表现还原性;从溴水中获取溴单质采用萃取的方法,所以第二次通入Cl2后,要提取Br2还要进行的操作为萃取,
故答案为:2Br-+Cl2=2Cl-+Br2;还原;萃取;
(2)通过以上分析知,为了实现对镁离子的富集,①中加入的足量试剂是NaOH,
A.氧化镁熔点很高,电解熔融态氧化镁会增加成本,故不适合;
B.真空、高温还原MgO增加成本,且条件难以控制,故不适合;
C.镁是活泼金属,采用电解熔融氯化镁的方法冶炼镁,故适合;
D.镁是活泼金属,不能采用置换法获取,故不适合;
故选C;
故答案为:NaOH;C.
