目前,世界上生产的镁有60%来自海水,其生产流程图如下
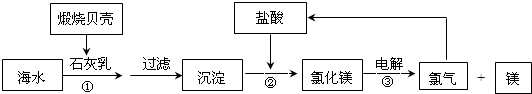
(1)贝壳的主要化学成分为______(写化学式);
(2)写出反应②的离子方程式:______
(3)写出Mg与CO2反应的化学方程式,并标出电子转移的方向与数目:______其中还原剂是______
(4)电解氯化镁所得的氯气除用于生产盐酸外,请举出氯气在工业上的另一种用途(用化学方程式表示)
______.
煅烧贝壳发生的反应为CaCO3
CO2↑+CaO,氧化钙和水反应制得石灰乳,反应方程式为:CaO+H2O=Ca(OH)2,镁离子和石灰乳反应生成氢氧化镁沉淀,离子方程式为:Mg2++2OH-=Mg(OH)2↓,氢氧化镁和稀盐酸反应生成氯化镁,反应方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,电解熔融氯化镁制得Mg,反应方程式为:MgCl2(熔融)高温 .
Mg+Cl2↑,氢气在氯气中燃烧得到氯化氢,反应方程式为H2+Cl2=2HCl,电解 .
(1)贝壳的主要成分是碳酸钙,其化学式为CaCO3,故答案为:CaCO3;
(2)氢氧化镁和稀盐酸发生复分解反应生成氯化镁和水,离子反应方程式为:Mg(OH)2+2H+═Mg2++2H2O,
故答案为:Mg(OH)2+2H+═Mg2++2H2O;
(3)镁在二氧化碳中燃烧生成氧化镁和碳,该反应中Mg元素化合价由0价变为+2价、C元素化合价由+4价变为0价,转移电子数为4, ,该反应中的还原剂是Mg,
,该反应中的还原剂是Mg,
故答案为: ;Mg;
;Mg;
(4)氯气是制备漂粉精的主要原料,发生的反应为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O.
