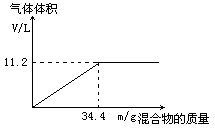
在100mLNaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应,下图表示加入的混合物的质量和产生气体的体积(标准状况)关系。
(1)试计算NaOH溶液的物质的量浓度。
(2)当NaOH溶液的体积为140mL,固体混合物的质量为51.6g,充分反应后,生成气体的体积(标准状况)为多少升?
(3)当NaOH溶液的体积为180mL,固体混合物的质量仍为51.6g,充分反应后,生成气体的体积(标准状况)为多少升?
解:(1)5mol/L (3分) (2)15.68 L(3分)(3)16.8L(3分)
考查化学计算的过量与不足问题
(1)由图像可知,随着混合物的质量的增加,所得到的氨气的最大体积为11.2L
由反应NH4++OH-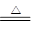 NH3↑+H2O可知,OH-的物质的量为0.5mol,NaOH溶液的物质的量浓度为5mol/L
NH3↑+H2O可知,OH-的物质的量为0.5mol,NaOH溶液的物质的量浓度为5mol/L
34.4g混合物中所含NH4+的量为0.5mol,设NH4NO3、(NH4)2SO4的物质的量分别为x、y
80x+132y=34.4 x+2y=0.5
解得x=0.1mol y=0.2mol,即两者的物质的量比为1:2
(2)140mlNaOH提供的OH-的物质的量为0.7mol
固体混合物的质量为51.6g,可计算出NH4NO3、(NH4)2SO4的物质的量分别为0.15mol、0.3mol,提供NH4+的量为0.75mol
由反应NH4++OH-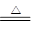 NH3↑+H2O可知,OH-的量相对不足,生成的氨气为0.7mol,标准状况下体积为22.4×0.7=15.68 L
NH3↑+H2O可知,OH-的量相对不足,生成的氨气为0.7mol,标准状况下体积为22.4×0.7=15.68 L
(3)180mlNaOH提供的OH-的物质的量为0.9mol,与固体相比NH4+的量不足,所生成氨气为0.75mol,标准状况下体积为22.4×0.75=16.8L
