镁是一种性质活泼、用途广泛的金属,研究镁的冶炼性质对于生产、生活意义重大.
(一)目前世界上60%的镁是从海水中提取的.已知从海水中提炼镁的主要步骤如图:

学生结合这个课题提出了以下问题:
(1)从海水中提取镁的过程中如何实现对镁的富集?
学生1的观点:直接往海水中加入沉淀剂.
学生2的观点:高温加热蒸发海水后,再加入沉淀剂.
学生3的观点:利用上述海水晒盐后剩余的溶液,加入沉淀剂.
请你评价三个学生提出的观点是否合理(填“是”或“否”),若不合理请简述理由.
| 观点 | 是否正确 | 简述理由 |
| 学生1 | 否 | ______ |
| 学生2 | ______ | ______ |
| 学生3 | ______ | ______ |
①过程中所用沉淀剂的制造原料也来源于海洋,则该沉淀剂是______(填化学式).
②试从节约能源,提高金属镁的纯度分析,以下最适宜的冶炼镁的方法是______(填选项字母).
A.Mg(OH)2
MgO△
Mg电解 2800℃
B.Mg(OH)2
MgO△
MgC真空 1352℃
C.Mg(OH)2
无水MgCl2①过量盐酸 ②△
Mg电解 714℃
D.Mg(OH)2
MgCl2溶液盐酸
Mg活泼金属 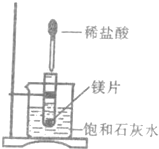
(二)为了研究镁的性质,先用工业制得的纯净的镁做如图所示实验.把试管放入盛有25℃饱和石灰水的烧杯中,然后在试管中放入镁片,再用滴管滴入一定量盐酸.请回答:
(1)实验中观察到的现象有
①______;②______;③______;
(2)烧杯中产生对应现象的原因为______.
(一)(1)学生1:还是中氯化镁浓度很小,向溶液中加入石灰乳时,二者几乎不产生Mg(OH)2沉淀,所以该观点不合理;
学生2:高温蒸发海水后使NaCl过饱和而析出,从而使Mg(OH)2沉淀中混有较多NaCl杂质,导致不纯,所以该该浓度不合理;
学生3:利用晒盐后的苦卤,节约能源,成本低;与学生1相比镁离子浓度高,有利于镁元素的富集,所以该观点正确,
故答案为:
| 海水中氯化镁浓度太小,直接加沉淀剂几乎不产生Mg(OH)2沉淀 | ||
| 否 | 高温蒸发海水后会使NaCl过饱和而析出,从而使Mg(OH)2沉淀中混有较多NaCl杂质 | |
| 是 | 镁离子富集浓度高,成本低 |
②A.MgO熔点很高,电解熔融MgO制取Mg,会导致成本较高,不利于节约能源,故A错误;
B.MgO熔点很高,电解熔融MgO制取Mg,会导致成本较高,不利于节约能源,且电解熔融MgO条件不易控制,故B错误;
C.电解熔融氯化镁制取镁符合节约能源,且能制取较纯净的镁,故C正确;
D.氯化镁溶液和活泼金属不能发生置换反应生成Mg,故D错误;
故选C;
(二)(1)在金属活动性顺序表中,Mg位于氢之前,Mg和稀HCl反应生成可溶性的MgCl2和氢气,且放出大量热,温度越高,Ca(OH)2的溶解度越小,所以Mg和稀HCl反应的过程中放出的热量导致有Ca(OH)2析出,所以看到的现象是:试管中有气泡产生、镁片逐渐溶解、烧杯中溶液变浑浊,
故答案为:①试管中有气泡产生;②镁片逐渐溶解;③烧杯中溶液变浑浊;
(2)温度越高,Ca(OH)2的溶解度越小,所以Mg和稀HCl反应的过程中放出的热量导致有Ca(OH)2析出,故答案为:镁片与盐酸反应并放热,Ca(OH)2的溶解度随温度升高而降低.
