某同学模仿物理课上学到的“串联电路”,设计了如下气体制取与性质验证的组合实验。打开分液漏斗活塞后,A中出现大量气泡,B中白磷燃烧,C中液面下降。请看图回答问题:
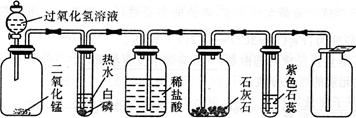
A B C D E F
(1) A中反应的化学方程式为: 。
(2)B中白磷能够燃烧的原因是 。
(3) D中的实验现象是 ,
反应的化学方程式为 。
(4) E中的实验现象是 ,
反应的化学方程式为 。
(5) 用F装置收集气体的依据是 。
(6)现用大理石与稀盐酸反应制取二氧化碳气体,反应产生的二氧化碳气体的质量与加入的稀盐酸的质量关系如图所示。(提示:大理石中的杂质不发生反应,气体的溶解忽略不计)求:稀盐酸中溶质的质量分数是多少?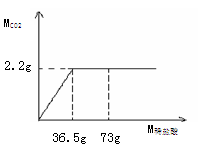
(1)2H2O2 MnO2 2H2O + O2↑
(2)与氧气接触,温度达到着火点。
(3)C中液体进入D中,有气泡产生; CaCO3 + 2HCl== CaCl2 + H2O + CO2↑
(4)导管口有气泡冒出,溶液由紫色变红色; CO2 + H2O== H2CO3
(5)气体的密度比空气密度大
(6)10%
:(1)由题意知,反应物双氧水,生成物水和氧气,反应条件为二氧化锰,故
2H2O2 MnO2 2H2O + O2↑;
(2)B中白磷能够燃烧的原因是白磷的温度达到着火点,与氧气接触;
(3)氧气流进入C,则把盐酸压入D和石灰石反应生成二氧化碳,反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(4)二氧化碳气体进入E,与水反应生成碳酸,紫色石蕊遇酸变红色;反应的化学方程式为:CO2+H2O=H2CO3
(5)用F装置是向上排空气法,适合收集密度比空气大的气体,故收集气体的依据是气体密度比空气密度大.
(6)解:设稀盐酸中溶质HCl的质量为X
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
2×36.5 44
X 2.2g
2×36.5 /44 ="X/" 2.2g ……………………(1分)
X =3.65 g ……………………(1分)
稀盐酸中溶质HCl的质量分数为:3.65g /36.5g g×100% =10% …………(1分)
答:稀盐酸中溶质HCl的质量分数为10 %。
