如图是现今常规生产发烟硫酸和硫酸的流程图:
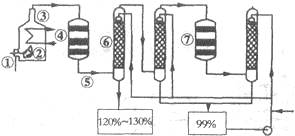
(1)在④处二氧化硫被氧化成三氧化硫,④的设备名称是 ,该处发生反应的方程式为 ,为提高三氧化硫的产率,该处应采用 (填“等温过程”或“绝热过程”)为宜。
(2)在⑦处进行二次催化处理的原因是 。
(3)⑤处气体混合物主要是氮气和三氧化硫.此时气体经过⑥后不立即进入⑦是因为 。
(4)20%的发烟硫酸(SO3的质量分数为20%)1吨需加水 吨(保留2位有效数字)才能配制成98%的成品硫酸。
(5)在②处发生1500℃的“不完全燃烧”,即先混入少量干燥空气,然后在③处于700℃下再继续燃烧.试简述这种燃烧方式对环境保护是有利的原因 。
(1)接触室 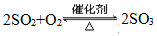 ,等温过程;
,等温过程;
(2)反应是可逆反应,二次催化使尚不未反应的SO2尽量催化氧化成SO3,可以降低成本,提高原料的利用率和保护环境;
(3)通过吸收塔后,混合气体中SO3含量较多,不利于SO2的催化氧化反应进行。
(4)0.066
(5)在高温下空气的氮气和氧气反应生成氮氧化物,有污染;低温下氮氧化物被还原生成N2,对环境保护有利。
(1)二氧化硫被氧化成三氧化硫的设备为接触室;SO2和O2反应生成SO3,该反应正反应方向是是可逆反应,温度过高平衡逆向移动,不利于 SO3 的生成,且影响催化剂的活性,所以采用等温过程。
(2)通过一次催化炉不可能将二氧化硫全部氧化成三氧化硫,为充分利用原料,所以设置二次催化炉,使尚未反应的二氧化硫尽量氧化成三氧化硫,这样对降低成本和环境的保护是有利的。
(3)⑤处中的混合气体主要是三氧化硫和氮气,以及少量的二氧化硫,通过口吸收塔⑥后,只能吸收一部分三氧化硫。若将这种含三氧化硫较多,二氧化硫含量较少的混合气体直接通入第二个催化炉⑦,这时带入催化剂表面的三氧化硫的分压较高,二氧化硫分压较低,不利于反应的进行。
(4)SO3+H2O=H2SO4,需要水的质量为m(H2O)=1t×20%×18/80=0.045t,浓硫酸中含水的质量为(0.8t+0.2t×98/80) ×2%=0.0209t,所以需要水的质量是0.045t+0.0209=0.066t。
(5)在高温下,1500℃,空气的氮气和氧气反应生成氮氧化物,有污染;低温下,如700℃,氮氧化物被还原,生成N2,对环境保护有利。