问题
填空题
(11分)海水中化学资源的利用具有非常广阔的前景。
(1)目前世界上60%的镁是从海水中提取的,其主要步骤如下:
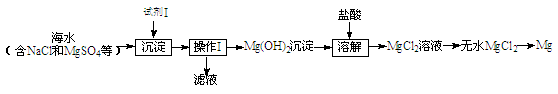
①试剂Ⅰ适宜选用 (填序号)。
A.盐酸 B.石灰乳 C.氯化钠溶液
②操作Ⅰ的名称是 。
③工业上通过电解熔融的MgCl2制备金属Mg,该反应的化学方程式是 。
(2)下图是某课外小组在实验室模拟从海水中提取溴的实验装置。
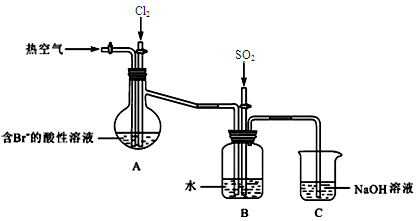
A装置中通入Cl2一段时间后,改通热空气,将Br2吹出至B装置。
①A装置中发生反应生成Br2的离子方程式为 。
② B装置中,Br2被SO2还原,B装置中产生的两种主要阴离子的符号为 、 。
③C装置中NaOH溶液的作用是 。
答案
(1)①B ②过滤 ③ MgCl2 Mg + Cl2↑
Mg + Cl2↑
(2)①Cl2+2Brˉ=== 2Clˉ+Br2 ② SO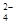 Brˉ
Brˉ
③防止Cl2、SO2、Br2对环境污染(答出一点即可)
题目分析:⑴①据题意选项中只有石灰乳与MgSO4反应生成Mg(OH)2沉淀。
②通过过滤将Mg(OH)2沉淀分离出来。
③电解熔融的MgCl2生成Mg和Cl2。
⑵①A装置中Cl2与Brˉ发生氧化还原反应生成Br2和Clˉ。
②Br2与SO2在水溶液中反应方程式为Br2+ SO2+2H2O=H2SO4+2HBr,其产生的两种阴离子为SO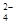 和Brˉ。
和Brˉ。
③该装置会带来Cl2、SO2、Br2等有毒气体,用NaOH溶液能吸收这些气体,防止其污染空气。
