合成氨反应(N2+3H2 2NH3+92.4KJ)在化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。
2NH3+92.4KJ)在化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。
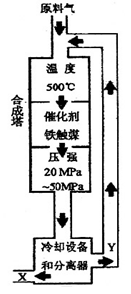
30. X的化学式为 ;X的状态为_______态。
31. 据右图分析,下列说法正确的是 (填写编号)。
a.在此温度下,有利于平衡正向移动,可提高氨的产量
b.铁触媒的使用有利于平衡正向移动
c.工业生产受动力、材料、设备等条件的限制,选择此压强
d.为提高原料的转化率,采用循环操作
32. 常温下氨气极易溶于水,其水溶液可以导电。
① 氨水中水的离子积常数的数值是_______________________;
② 将相同体积、相同物质的量浓度的氨水和盐酸混合后,
溶液中离子浓度由大到小依次为 。
30. NH3;液 (2分)
31. c、d(2分、选对1个得1分,错选、多选不得分)
32. ① 10-14 ② c(Cl—)>c(NH4+)>c(H+)>c(OH—) (2分)
题目分析:30.因为NH3分离时成为液体,有最下部流出,故X是NH3为液态。
31.a.由于反应正向放热,在500℃下,高温不利于平衡正向移动。不正确;b.铁触媒只加快反应速率,不改变平衡,说法不正确;c.工业生产受动力、材料、设备等条件的限制,选择此压强,正确;d.为提高原料的转化率,采用循环操作,正确。
32.②将相同体积、相同物质的量浓度的氨水和盐酸混合后,生成NH4Cl,NH水解显酸性,故溶液中离子浓度由大到小依次为c(Cl—)>c(NH4+)>c(H+)>c(OH—)。4Cl溶液中的离子浓度大小比较。