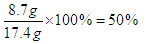问题
计算题
(12分)取含MnO2的软锰矿17.4g与足量浓HCl反应后,将生成的Cl2通入含22g NaBr(过量)的水溶液中,经加热蒸发水分并烘干后,质量减少了8.9g,剩余13.1g的残渣。计算:
(1)生成 NaCl多少克?
(2)生成Cl2(标准状况下)体积多少升?
(3)软锰矿含MnO2的质量分数。
答案
(1)11.7g(4分) (2)2.24L(4分) (3)50%(4分)
本题可采用差量法进行计算。
(1) 2NaBr+Cl2 = 2NaCl+Br2 质量减少
2×103g 1mol 2×58.5g 89g
X y 8.9g
所以x=0.1mol, y=11.7g
(2)根据(1)可知氯气在标准状况下的体积是0.1mol×22.4L/mol=2、24L
(3)MnO2+4HCl(浓)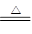 MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
87g 1mol
m 0.1mol
所以m=8.7g
因此软锰矿含MnO2的质量分数为