[化学选修——2:化学与技术](15分)
将海水淡化和与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是 (填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾.溴.镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是:Br2+Na2CO3+H2O  NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。
NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。
(3)海水提镁的一段工艺流程如下图:

浓海水的主要成分如下:

该工艺过程中,脱硫阶段主要反应的离子方程式为 ,产品2的化学式为 ,1L浓海水最多可得到产品2的质量为 g。
(4)采用石墨阳极.不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为 ;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式 。
(1)②③④
(2)5/3
(3)Ca2+ +SO42—====CaSO4↓ Mg(OH)2 69.6
(4)MgCl2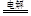 Mg + Cl2↑
Mg + Cl2↑
Mg + 2H2O Mg(OH)2 + H2↑
Mg(OH)2 + H2↑
题目分析:(1)用混凝法只能除去海水中的悬浮物,不能获取淡水,故设想和做法可行的是②③④。(2)利用化合价升降法配平氧化还原方程式:3Br2+6Na2CO3+3H2O ==== 5NaBr + NaBrO3+ 6NaHCO3,则吸收1mol Br2时转移的电子为5/3mol。(3)根据浓海水的成分及工艺流程知,脱硫阶段为用钙离子除去浓海水中的硫酸根,主要反应的离子方程式为Ca2+ +SO42—====CaSO4↓;由题给流程图知,产品2的化学式为Mg(OH)2,1L浓海水含镁离子28.8g,物质的量为1.2mol,根据镁元素守恒知,最多可得到Mg(OH)21.2mol,质量为69.6g。(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为MgCl2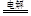 Mg + Cl2↑;电解时,若有少量水存在,高温下镁与水发生反应会造成产品镁的消耗,有关反应的化学方程式为Mg + 2H2O
Mg + Cl2↑;电解时,若有少量水存在,高温下镁与水发生反应会造成产品镁的消耗,有关反应的化学方程式为Mg + 2H2O Mg(OH)2 + H2↑。
Mg(OH)2 + H2↑。
