硫磺在科学技术和生产中有重要的应用。石硫合剂是一种很好的植物杀虫剂,它是硫磺与石灰、水等反应所得――由多硫化钙[ CaSx(x≤5)]、硫代硫酸钙组成的混合物。不同比例的石灰和硫磺在水溶液中反应,可生成不同的多硫化钙和硫代硫酸钙。如:
3Ca(OH)2+8S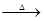 2CaS3+CaS2O3+3H2O;
2CaS3+CaS2O3+3H2O;
3Ca(OH)2+6S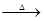 2CaS2+CaS2O3+3H2O等。
2CaS2+CaS2O3+3H2O等。
根据题意完成下列计算:
(1)、硫磺溶解在硫化钠溶液中生成一种多硫化物,该多硫化物中硫元素的质量分数为0.736,通过计算确定Na2Sx中x= 。
(2)、取某石硫合剂(假如只含两种含硫化合物)250mL(密度为1.12g/mL)通入足量CO2使其快速分解。原理如下:
Sx2-+2H2O+2CO2→(x-1)S↓+H2S↑+ 2HCO3-,S2O32- + H2O+CO2→HSO3-+HCO3-+S↓ 。
完全反应后共收集到气体1.12升(S·P·T)(忽略气体在溶液中的溶解),则该石硫合剂中多硫化钙的物质的量浓度为 ;硫代硫酸钙的质量分数为 。(答案用小数表示,保留2位有效数字)
(3)、如果把生石灰、硫磺和水按质量比7:16:70的配比完全反应后,只生成两种含硫的化合物,则该石硫合剂中多硫化钙与硫代硫酸钙的物质的量之比是 ;多硫化钙的化学式是 。
(4)、现有生石灰50.4g、硫磺96g、水504g恰好完全反应生成三种多硫化钙,除生成CaS4之外还有二种多硫化钙。请推算这二种多硫化钙可能的物质的量之比(写出推算过程)。
(1)、4 (2分) (2)、0.20 mol/L (2分) 0.014 (2分)
(3)、2:1 (2分) CaS5 (2分)
(4)、n(CaO)="50.4/56" =0.3mol n(S)="96/32" =3mol (1分)
则 n[Ca(OH)2 ]: n(S) =" 3" : 10 由反应可知:3Ca(OH)2+10S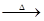 2CaSx+CaS2O3+3H2O
2CaSx+CaS2O3+3H2O
解之得:x="4" 即多硫化物中硫原子的平均值为4. (1分)
故另两种多硫化物可能为:CaS2与CaS5或CaS3与CaS5。 (2分)
由 可知,n(CaS2):n(CaS5)=1:2;(1分)
可知,n(CaS2):n(CaS5)=1:2;(1分)
由 可知,n(CaS3):n(CaS5)=1:1 (1分)
可知,n(CaS3):n(CaS5)=1:1 (1分)
其他和理解法也可以给分。
(1). 硫元素的质量分数为0.736,则钠元素的质量分数为0.264,所以钠原子和硫原子的个数之比是 ,所以x=4.
,所以x=4.
(2)硫化氢是0.05mol,所以根据方程式可知,多硫化钙的物质的量是0.05mol,其浓度是0.05mol÷0.25L=0.20 mol/L。其中+CaS2O3的物质的量是0.05mol÷2=0.025mol,所以其质量分数是 。
。
(3)生石灰、硫磺的质量比7:16,则物质的量之比是1︰4,即氢氧化钙和硫磺的物质的量之比是1︰4,所以方程式为3Ca(OH)2+12S 2CaSx+CaS2O3+3H2O,因此x=5。
2CaSx+CaS2O3+3H2O,因此x=5。
(4)n(CaO)="50.4/56" =0.3mol n(S)="96/32" ="3mol"
则 n[Ca(OH)2 ]: n(S) =" 3" : 10 由反应可知:3Ca(OH)2+10S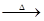 2CaSx+CaS2O3+3H2O
2CaSx+CaS2O3+3H2O
解之得:x="4" 即多硫化物中硫原子的平均值为4.
故另两种多硫化物可能为:CaS2与CaS5或CaS3与CaS5。
由 可知,n(CaS2):n(CaS5)=1:2;
可知,n(CaS2):n(CaS5)=1:2;
由 可知,n(CaS3):n(CaS5)=1:1
可知,n(CaS3):n(CaS5)=1:1
