问题
计算题
实验室使用的浓盐酸的溶质质量分数一般为36.5%,密度为1.19g.cm-3。
(1)求该浓盐酸的物质的量浓度。
(2)将多少升氯化氢(标准状况)通入2.00L水中可得36.5%的浓盐酸?
(3)取一定体积的该盐酸与足量二氧化锰在一定条件下反应,若生成标准状况下氯气33.6L,则被还原的HCl的物质的量是多少?
答案
(1)物质的量浓度和质量分数的关系是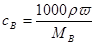
所以浓盐酸的物质的量浓度=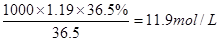
(2)根据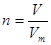 和
和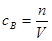 可知
可知
解得V(HCl)=705.51L
(3)标准状况下氯气33.6L
物质的量是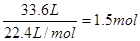
所以被还原的氯化氢是1.5mol×2=3mol
考查以物质的量为核心的有关计算。
