取A、B两份物质的量浓度相等的NaOH溶液,体积均为50 mL,分别向其中通入一定量的CO2后,再分别稀释为100 mL。
(1)在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是:
①________;②________;③________;④________。
(2)在稀释后的溶液中分别逐滴加0.1 mol/L的盐酸,产生的CO2的体积(标准状况)
与所加盐酸的体积关系如图所示:
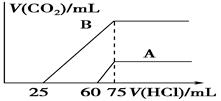
①分别加入足量的盐酸后的溶液中的溶质是________,原NaOH溶液的物质的量浓度为________。
②A曲线表明,原溶液通入CO2后,所得溶质与HCl反应产生CO2的最大体积是________mL(标准状况)。
③B曲线表明,原溶液通入CO2后,所得溶质的化学式为________,其物质的量之比为________。
(1)①Na2CO3和NaOH; ②Na2CO3;③ Na2CO3和NaHCO3;④NaHCO3
(以上4个填空无顺序要求)
(2) ①NaCl;0.15 mol/L ②33.6mL(标准状况)。③Na2CO3和NaHCO3;1:1
(1)氢氧化钠和CO2反应可逆生成正盐碳酸钠,或者酸式盐碳酸氢钠,所以溶液中溶质的组成可能是Na2CO3和NaOH;Na2CO3;Na2CO3和NaHCO3;NaHCO3。
(2)①如果加入足量的盐酸,则最终都生成氯化钠。根据图像可知,需要盐酸是75ml,所以氯化钠的物质的量是0.0075mol,所以根据原子守恒可知,氢氧化钠的物质的量是0.0075mol,因此原NaOH溶液的物质的量浓度为0.0075mol÷0.05L=0.15mol/L。
②由于碳酸钠和盐酸可以是分步进行的,所以根据曲线A可知,与碳酸氢钠反应的盐酸是75ml-60ml=15ml,因此生成CO2是0.015L×0.1mol/L=0.0015mol,体积是0.0015mol×22.4L/mol=0.0336L=33.6ml。
③根据曲线B可知,与碳酸氢钠反应的盐酸是75ml-25ml=50ml,则说明前25ml盐酸是和碳酸钠反应生成碳酸氢钠的,因此溶质是碳酸钠和碳酸氢钠。根据反应Na2CO3+HCl=NaCJ+NaHCO3、NaHCO3+HCl=NaCl+H2O+CO2↑可知,二者的物质的量是相等的。
