下图是100 mg CaC2O4·H2O受热分解时,所得固体产物的质量随温度变化的曲线。试利用图中信息结合所学的知识填空:

(1)温度分别为t1和t2时,固体产物的化学式A是________,B是________。产物C的化学式为 。
(2)由A得到B的化学方程式为___________________________________。
(1)CaC2O4 CaCO3 CaO (均1分,共3分)(2)CaC2O4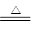 CaCO3+CO↑ (2分)
CaCO3+CO↑ (2分)
根据题目要求可分3段讨论CaC2O4•H2O的受热分解.
(1)t1时A点,100mgCaC2O4•H2O的质量减少至87.7mg,从中分析CaC2O4•H2O受热分解的产物,固体CaC2O4•H2O的摩尔质量为146g/mol,设分解后产物的摩尔质量为M1.100×10-3g÷146g/mo=87.7×10-3g÷M1,解得M1=128.04g/mol。由于CaC2O4的摩尔质量为128g/mol,从而判断出CaC2O4•H2O的分解反应方程式为:CaC2O4•H2O 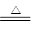 CaC2O4+H2O↑
CaC2O4+H2O↑
所以A的化学式是CaC2O4.
(2)再讨论t2时B点,87.7mg的CaC2O4受热分解,设分解产物的摩尔质量为M2.
则87.7×10-3g÷28g/mol=68.5×10-3g÷M2.解得M2=99.98g/mol。从M2的实验值可推断出产物B应为CaCO3,分解方程式为:CaC2O4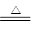 CaCO3+CO↑
CaCO3+CO↑
(3)综上分析,由CaC2O4•H2O得到A的化学方程式即为CaC2O4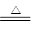 CaCO3+CO↑
CaCO3+CO↑
(4)当加热至1100℃~1200℃时,由图读得分解产物C的质量约为38mg,设C点化合物摩尔质量为M3.则68.5×10-3g÷100g/mol=38×10-3g÷M3.解得M3=55.47g/mol。M3的实验值与CaO的摩尔质量(56g/mol)接近,分解方程式应为:CaCO3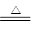 CaO+CO2↑。由此得出C的化学式为CaO,其分子量即为56.
CaO+CO2↑。由此得出C的化学式为CaO,其分子量即为56.
