18.0 mol·L-1的浓硫酸稀释成2.00 mol·L-1的稀硫 酸100 ml,实验操作如下:
(1)计算并用量筒量取 ml的18.0 mol·L-1的浓硫酸;
(2)将 沿烧杯内壁慢慢注入盛有少量 的烧杯中;
(3)将已冷却至室温的硫酸溶液沿玻璃棒注入 ___________;
(4)用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
(5)继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处,改用胶头滴管逐滴加蒸馏水,至液面与刻度线相切
(6)盖好容量瓶塞,反复颠倒摇匀,将配好的稀硫酸倒入试剂瓶中,贴好标签保存。
试分析下列操作对实验结果的影响(偏高、偏低或无影响)
①没有洗涤烧杯和玻璃棒
②定容时俯视读数
③容量瓶使用前有少许水残留
(1) 11.1 (2) 浓硫酸 、 水
(3) 100mL容量瓶 (6)① 偏低 ② 偏高 ③ 无影响
(1)稀释过程中溶质不变,所以浓硫酸的体积是
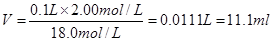 。
。
(2)浓硫酸溶于水放出大量的热,且浓硫酸的密度大于水的。所以稀释浓硫酸应该是将浓硫酸沿烧杯内壁慢慢注入盛有少量水的烧杯中。
(3)准确配制一定物质的量浓度溶液时,需要用相应规格的容量瓶。
(6)误差分析主要时依据c=n/V。
①没有洗涤,则溶质偏少,浓度偏低。
②定容时俯视读数,则容量瓶中溶液的体积偏少,浓度偏高。
③由于需要用蒸馏水定容,所以容量瓶中含有蒸馏水对结果是不影响的。
