某小组设计如图装置:可用于制取多种气体,也可用于验证物质的性质.
(1)关闭K2,打开K1时,可用装置I收集装置I所产生的气体,下列气体中能用此法收集的是:______.
A.O2 B.H2 C.NO D.SO2
写出实验室制备该气体的离子方程式:______.
上述另外几种气体中,若在装置Ⅱ中加满水,还不能制取和收集的是______.
若要收集该气体,改进的方法是______.
(2)利用I、Ⅲ装置比较物质的氧化性(K2打开,K1关闭):KMnO4>Cl2>Br2,在A中加浓盐酸时,应在B中加______,C中加______.C中的现象是______,装置Ⅲ中仪器D的作用是______.
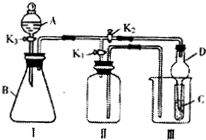
(1)装置II中短管进气,为向下排空气法,SO2和O2的密度比空气大,应该用向上排空气法收集,NO能与空气中的氧气反应,所以NO不能用排气法收集,则能用向下排空气法收集的是氢气;
实验室用Zn与稀硫酸制备氢气,其反应的离子方程式为:Zn+2H+=Zn2++H2↑;
SO2易溶于水不能用排水法收集;SO2在饱和NaHSO3溶液中溶解度较小,所以SO2可以用排饱和NaHSO3溶液的方法收集,
故答案为:B; Zn+2H+=Zn2++H2;SO2;将I装置加满饱和NaHSO3溶液;
(2)依据实验装置图可知,A和B反应,生成产物通入C中反应,如证明氧化性:KMnO4>Cl2>Br2,需要根据氧化还原反应的氧化剂的氧化性大于氧化产物的规律分析判断,A为浓盐酸,滴入B中与高锰酸钾反应生成氯气,氯气通入C中与溴化钠溶液中反应生成溴单质,则C中溶液呈橙色;导气管下端连接球形干燥管,可以防倒吸;
故答案为:KMnO4固体;NaBr溶液;溶液呈橙色;防止倒吸.
