(12分)(1)某化学兴趣小组对“农夫山泉”矿泉水进行检测时,发现1.0L该矿泉水中含有45.6mgMg2+,则该矿泉水中Mg2+的物质的量浓度为 。
(2)在Na2SO4和MgSO4的混合溶液中,Na+与Mg2+的个数比为1:2,则Na2SO4和MgSO4的物质的量之比为 。
(3)在aLAl2(SO4)3和(NH4)2SO4的混合溶液中加入bmolBaCl2,恰好使溶液中的SO42—完全沉淀;如加入足量强碱并加热可得到c molNH3,则原溶液中Al3+的浓度 。
(4)等质量的CuO和MgO粉末分别溶于相同体积的硝酸中完全溶解,得到Cu(NO3)2和Mg(NO3)2溶液的浓度分别为amol/L和bmol/L。则a与b的关系为 。
(1)0.0019mol/L,(2)1:4,(3)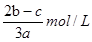 ,(4)b=2a
,(4)b=2a
(1)镁的摩尔质量是24g/mol,所以45.6mgMg2+是1.9×10-3mol/L,所以根据c=n/V可知,镁离子浓度是0.0019mol/L。
(2)Na+与Mg2+的个数比为1:2,则根据硫酸钠和硫酸镁的化学式可知,Na2SO4和MgSO4的物质的量之比为1/2︰2=1︰4。
(3)根据方程式Ba2++SO42-=BaSO4、NH4++OH-=MH3↑+H2O可知,溶液中SO42—是bmol,NH4+是cmol,所以根据电荷守恒可知,铝离子物质的量是(2b-c)/3,所以其浓度是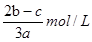 。
。
(4)在质量相同时,氧化铜和氧化镁的物质的量之比是40︰80=1︰2,所以根据原子守恒可知,b=2a。
