(15分)某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为测定其组成,进行如下实验。
①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1mLc1 mol·L—1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L—1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。

②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是 。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用 式滴定管,可使用的指示剂为 。
(3)样品中氨的质量分数表达式为 。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将 (填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是 ;滴定终点时,若溶液中c(Ag+)=2.0×10—5 mol·L—1,c(CrO42—)为 mol·L—1。(已知:Ksp(Ag2CrO4)=1.12×10—12)
(6)经测定,样品X中钴.氨.氯的物质的量之比为1:6:3,钴的化合价为 ,制备X的化学方程式为 ;X的制备过程中温度不能过高的原因是 。
当A中压力过大时,安全管中液面上升,使A瓶中压力稳定
碱 酚酞(或甲基红)
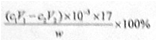
偏低
防止硝酸银见光分解 2.8×10—3
+3 2CoCl2+2NH4Cl+10NH3+H2O2 2[Co(NH3)6]Cl3+2H2O 温度过高过氧化氢分解、氨气逸出
2[Co(NH3)6]Cl3+2H2O 温度过高过氧化氢分解、氨气逸出
题目分析:(1)分析题给装置知,装置中安全管的作用原理是当A中压力过大时,安全管中液面上升,使A瓶中压力稳定。(2)用NaOH标准溶液滴定过剩的HCl时,应使用碱式滴定管,可使用的指示剂为酚酞(或甲基红)。(3)根据题给信息知,氨的测定过程中发生反应HCl+NH3 NH4Cl,则样品中氨的物质的量与和氨气反应的HCl的物质的量相等,为(c1V1—c2V2)×10—3mol,则氨气的质量为
NH4Cl,则样品中氨的物质的量与和氨气反应的HCl的物质的量相等,为(c1V1—c2V2)×10—3mol,则氨气的质量为
(c1V1—c2V2)×10—3×17g,质量分数表达式为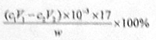 。(4)测定氨前应该对装置进行气密性检验,若气密性不好会导致氨气逸出,测定结果将偏低。(5)测定氯的过程中,用硝酸银溶液滴定,硝酸银见光易分解,故使用棕色滴定管的原因是防止硝酸银见光分解;根据沉淀溶解平衡知识知,c(CrO42—) =Ksp(Ag2CrO4)/ c2(Ag+)= 1.12×10—12/(2.0×10—5)2=2.8×10—3mol·L—1。(6)根据题意知,样品X中钴、氨、氯的物质的量之比为1:6:3,则X的化学式为[Co(NH3)6]Cl3,利用化合价规则判断,钴的化合价为+3;根据题给信息知,CoCl2·6H2O、NH4Cl、H2O2、浓氨水在活性炭催化下,合成橙黄色晶体X,化学方程式为2CoCl2+2NH4Cl+10NH3+H2O2
。(4)测定氨前应该对装置进行气密性检验,若气密性不好会导致氨气逸出,测定结果将偏低。(5)测定氯的过程中,用硝酸银溶液滴定,硝酸银见光易分解,故使用棕色滴定管的原因是防止硝酸银见光分解;根据沉淀溶解平衡知识知,c(CrO42—) =Ksp(Ag2CrO4)/ c2(Ag+)= 1.12×10—12/(2.0×10—5)2=2.8×10—3mol·L—1。(6)根据题意知,样品X中钴、氨、氯的物质的量之比为1:6:3,则X的化学式为[Co(NH3)6]Cl3,利用化合价规则判断,钴的化合价为+3;根据题给信息知,CoCl2·6H2O、NH4Cl、H2O2、浓氨水在活性炭催化下,合成橙黄色晶体X,化学方程式为2CoCl2+2NH4Cl+10NH3+H2O2 2[Co(NH3)6]Cl3+2H2O;X的制备过程中温度不能过高的原因是温度过高过氧化氢分解、氨气逸出。
2[Co(NH3)6]Cl3+2H2O;X的制备过程中温度不能过高的原因是温度过高过氧化氢分解、氨气逸出。
