现有A、B、C、D、E五种易溶于水的强电解质,它们由如下离子组成(各种离子不重复)。
| 阳离子 | H+、NH4+、Mg2+、Ba2+、Al3+ |
| 阴离子 | OH-、Cl-、HCO3-、NO3-、SO42- |
③C溶液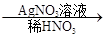 白色沉淀。请回答下列问题:
白色沉淀。请回答下列问题:
(1)写出下列物质的化学式:A______________、B______________。
(2)写出“C溶液 白色沉淀”有关反应的离子方程式____________________________。
白色沉淀”有关反应的离子方程式____________________________。
(3)D、E两种物质中必有一种是_______________,写出将少量该物质的溶液滴加到B溶液中反应的离子方程式___________________________________________________________________。
(4)请你设计实验确定C及另一种未知物各是什么物质。(只许在A~E中选择检验试剂)
| 实验步骤 | 预期现象和结论 |
| 取适量C的溶液于试管中, ① 。 | 预期现象和结论1: ② ; 预期现象和结论2: ③ ; |
(14分)(1)A:H2SO4 B:Ba(OH)2 (2)Ag++Cl-=AgCl↓ (各2分,共6分)
(3) NH4HCO3 NH4++HCO3-+Ba2++2OH-=BaCO3↓+NH3·H2O+H2O (各2分,共4分)
(4) ①向其中加入足量的Ba(OH)2溶液; (2分)
②若开始有白色沉淀生成,最终无沉淀生成,则C为AlCl3;
③若自始至终有白色沉淀生成,则C为MgCl2 (各1分,共2分)
(或:①向其中加入溶液NH4HCO3;②若既有气体又有白色沉淀生成,则C为AlCl3;③若无任何现象,则C为MgCl2。 (其它方法正确也给分)
题目分析:(1)0.1 mol/L A溶液的pH<1,这说明A应该是二元强酸,所以A是硫酸。将B溶液分别与其它四种溶液混合,均有白色沉淀生成,这说明B中含有OH-和Ba2+,即B是氢氧化钡,且一定不存在硝酸铵或氯化铵。
(2)C溶液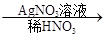 白色沉淀,说明C中含有氯离子,反应的离子方程式是Ag++Cl-=AgCl↓。
白色沉淀,说明C中含有氯离子,反应的离子方程式是Ag++Cl-=AgCl↓。
(3)又因为HCO3-和Al3+不能大量共存,又一定不存在硝酸铵或氯化铵,所以D、E两种物质中必有一种是NH4HCO3。则将少量该物质的溶液滴加到B溶液中反应的离子方程式NH4++HCO3-+Ba2++2OH-=BaCO3↓+NH3·H2O+H2O,
(4)根据以上分析可知,C是氯化铝或氯化镁,而另外一种物质是硝酸镁或硝酸铝。因此可以根据氢氧化铝的两性进行检验,所以要检验C的成分,正确的操作应该是①向其中加入足量的Ba(OH)2溶液;②若开始有白色沉淀生成,最终无沉淀生成,则C为AlCl3;③若自始至终有白色沉淀生成,则C为MgCl2。
(或:①向其中加入溶液NH4HCO3;②若既有气体又有白色沉淀生成,则C为AlCl3;③若无任何现象,则C为MgCl2。)
点评:该题综合性强,难度较大,对学生的思维能力要求高,学生不易得分。试题在注重对学生基础知识巩固和检验对同时,侧重对学生答题能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,有助于提升学生的学科素养,提高学生的学习效率和学习积极性。注意基础知识的积累、总结和运用。
