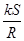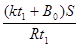( 14分)某化学小组进行Na2O2与水反应的实验,如下图所示,该小组对试管c中红色褪去的原因进行探究。

(1)Na2O2中含有的化学键类型: ;请写出a中反应的化学方程式 。
查阅资料:
①当NaOH溶液pH≥13时,可以使酚酞由红色褪为无色;
②Na2O2与水反应分两步进行:Na2O2 + H2O =" NaOH" + H2O2 2H2O2 = 2H2O + O2↑
(2)请设计实验验证Na2O2与水反应后的溶液中有H2O2残留:取少量b溶液于试管中, ,证明溶液中有H2O2残留。
(3)结合资料,该小组同学针c中溶液红色褪去的原因提出以下假设:
① ;
② 溶液中H2O2破坏酚酞的结构;
③ NaOH和H2O2共同作用结果。
(4)该小组同学测出c中溶液的pH为14,认为还不能排除假设②、③,于是又进行了如下实验,请完成下表空白处:
| 实验 | 操作 | 现象 | 结论 |
| 1 | 向少量H2O2中滴加2滴酚酞,放置一段时间,再加入NaOH溶液至pH=12 | 加入NaOH后,无色溶液先变红,后褪色 | ①
|
| 2 | 向少量 NaOH溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 | 溶液先变红,后褪色;加盐酸后,又出现红色,且不褪色 |  |
| 3 | 向Na2O2与水反应后的溶液(pH=14)中滴加2滴酚酞;再加适量稀盐酸至溶液 pH=12 …… | ② …… | 溶液pH大于13时,NaOH使变红的溶液褪色;pH在8~13时, NaOH和H2O2共同作用使溶液褪色 |
(14分)
(1)离子键、非极性共价键 (2分)
2Na2O2 + 2H2O = 4NaOH + O2 ↑ (2分)
(2)加入少量MnO2粉末,产生大量气泡,用带火星的木条检验,木条复燃。 (2分)
(3)① 溶液中NaOH浓度较大,pH≥13 (2分)
(4)① 仅H2O2不能破坏酚酞结构,酚酞褪色是H2O2和NaOH共同作用结果。
(或 假设②不正确,假设③正确) (2分)
②溶液先变红,后褪色;加稀盐酸后,又出现红色,但随后褪色。 (2分)
(5)加入稀盐酸,会因发生中和反应而放热,使溶液温度升高。
题目分析:(1)Na2O2中含有的化学键类型有离子键、非极性共价键;Na2O2与水反应生成氢氧化钠和氧气,化学方程式为2Na2O2 + 2H2O = 4NaOH + O2 ↑
(2)证明过氧化氢的存在,利用其在二氧化锰作催化剂的条件下发生分解反应,生成氧气来判断。操作步骤是加入少量MnO2粉末,产生大量气泡,用带火星的木条检验,木条复燃。
(3)当NaOH溶液pH≥13时,可以使酚酞由红色褪为无色;所以① 的假设是溶液中NaOH浓度较大,pH≥13;
(4)实验1的现象说明①仅H2O2不能破坏酚酞结构,酚酞褪色是H2O2和NaOH共同作用结果;
实验3的结论说明Na2O2与水反应后的溶液(pH=14>13),所以滴加2滴酚酞先变红后褪色;加入盐酸使氢氧根离子浓度减小,又出现红色,pH在8~13时,NaOH和H2O2共同作用使溶液褪色,所以最终溶液褪色。
(5)加水稀释不变红,加盐酸后变红,因为加盐酸后发生中和反应,中和反应是放热反应,体系温度升高,溶液红色出现。