问题
填空题
(8分)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl—、ClO—、ClO3—三种含氯元素的离子,其中ClO—、ClO3—两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
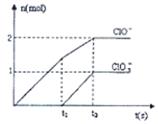
(1)t1前,氧化产物是________(填化学式)。
(2)t2时,Ca(OH)2与Cl2发生反应的总的离子方程式为: 。
(3)该石灰乳中含有Ca(OH)2的物质的量是 mol。
(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,其爆炸后的产物可能是 。
A.NaCl、Cl2
B.NaCl、NaClO
C.NaClO3、NaClO4
D.NaCl、NaClO3
答案
(1)Ca(ClO)2 (2)5Ca(OH)2+5Cl2=5Ca2++7Cl-+2ClO-+ClO3—+5H2O (3)5 (4)D
(1)根据图像可知,t1之前氧化产物是Ca(ClO)2。
(2)t2时,氧化产物既有Ca(ClO)2、还有Ca(ClO3)2,二者的物质的量分别是是1mol和0.5mol,所以转移电子是7mol,则生成3.5mol氯化钙,因此方程式为5Ca(OH)2+5Cl2=5Ca2++7Cl-+2ClO-+ClO3—+5H2O。
(3)根据原子守恒可知,氢氧化钙的物质的量是1mol+0.5mol+3.5mol=5mol。
(4)亚氯酸钠固体爆炸所以自身的氧化还原反应,所以氯元素的化合价既有升高的,还有降低的,则答案选D。
