Na2S2O3·5H2O在化学定量分析中常用作基准物质,实验室制备原理为:2Na2S+Na2CO3+4SO2 3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
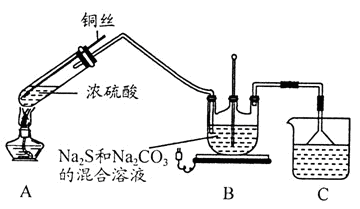
(1)A中发生的化学反应方程式为 。
(2)C中所盛试剂可能是 ;若要停止A中的化学反应,除取下酒精灯停止加热外,还可以采取的操作是 。
(3)学生乙在加热A后,发现液面下的铜丝变黑。对黑色生成物该学生提出如下假设:
①可能是CuO ②可能是Cu2O ③可能是CuS
学生丙提出假设②一定不成立,依据是 ;该生用如下实验进一步验证黑色物质的组成:

基于上述假设分析,黑色物质的组成为 (填化学式)。
(4)实验室用Na2S2O3标液测量废水Ba2+的浓度,过程如下:
(已知:2 S2O32一+I2=S4O62—+2 I-)

①写出BaCrO4沉淀与过量HI、HCl溶液反应的离子方程式 ;
②以淀粉为指示剂,则到达滴定终点的现象是 ;
③若标液Na2S2O3的浓度0.0030mol·L-1,消耗该Na2S2O3溶液体积如图,则废水Ba2+的浓度为 。
(1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)氢氧化钠溶液 可将铜丝抽离液面已停止反应
(3)Cu2O为砖红色
(4)2BaCrO4+6I-+16H+=3I2+2Cr3++2Ba2++8H2O 滴入最后一滴溶液,锥形瓶内溶液有蓝色变为无色,维持30s不变, 0.0011mol/L
题目分析:(1)金属铜和浓硫酸反应生成二氧化硫气体,根据质量守恒定律不难写出相关化学方程式。(2)
吸收未反应的二氧化硫气体和生成的二氧化碳气体,采用的尾气处理溶液为氢氧化钠溶液。把铜丝抽
离液面反应就可以停止。(3)氧化亚铜颜色为红色的;黑色物质不溶于硫酸,所以该黑色物质不可能是
氧化铜,应该是硫化铜;(4)根据反应物和生成物不难写出相关离子方程式;当滴入最后一滴溶液,
锥形瓶内溶液由蓝色变成无色,且保持30s不变;消耗该Na2S2O3溶液体积,27.80ml-0.30ml=27.50ml,
关系式:Ba2+ - BaCrO4 -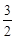 I2 -3 S2O32一;n(Ba2+)=
I2 -3 S2O32一;n(Ba2+)=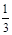 ×27.50×10-3L×0.0030mol·L-1=2.75×10-5mol,Ba2+的浓度为:
×27.50×10-3L×0.0030mol·L-1=2.75×10-5mol,Ba2+的浓度为: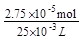 =1.1×10-3mol·L-1。
=1.1×10-3mol·L-1。
