(14分)碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
(1)合成该物质的步骤如下:
步骤1:配制0.5 mol·L-1MgSO4溶液和0.5 mol·L-1NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL三口烧瓶中,开启搅拌器。温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤、洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
回答下列问题:
步骤3中加氨水后的离子方程式 。
(2)测定合成的MgCO3·nH2O中的n值。称量1.000 g碳酸镁晶须,放入如图所示的广口瓶中加入水滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,反应后期将温度升到30 ℃,最后的烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。
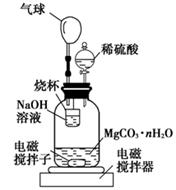
①图中气球的作用是 。
②上述反应后期要升温到30℃,主要目的是 。
③用已知浓度的盐酸滴定烧杯中的溶液时应选用 为指示剂,若盛放盐酸的滴定管在滴定前有气泡未排尽,滴定后无气泡(其他操作均正确),则所测CO2的量会 (填“偏大”“偏小”“无影响”)
④设3次实验测得每1.000 g碳酸镁晶须与稀硫酸反应产生的CO2平均值为a mol,则n值为 (用含a的表达式表示)。
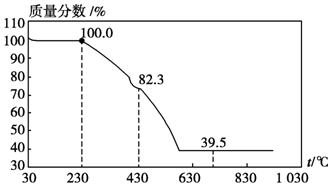
(3)称取100 g上述晶须产品进行热重分析,热重曲线如图。则该条件下合成的晶须中,n= (选填1、2、3、4、5)。
(1) NH3·H2O+Mg2++HCO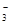 ===MgCO3↓+NH
===MgCO3↓+NH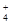 +H2O
+H2O
(2)①暂时储存CO2,有利于CO2被NaOH溶液吸收,且能保持装置中压强相对稳定
②使溶解在水中的CO2逸出,便于吸收 ③甲基橙,偏大 ④(1-84a)/18a (3)1
题目分析:(1)氨水是弱碱,与碳酸氢镁反应的离子方程式为NH3·H2O+Mg2++HCO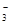 ===MgCO3↓+NH
===MgCO3↓+NH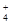 +H2O。
+H2O。
(2)①装置中气球可以暂时储存CO2,有利于CO2被NaOH溶液吸收,且能保持装置中压强相对稳定。②反应后期将温度升到30℃,使生成的二氧化碳全部逸出后被氢氧化钠溶液吸收,减少测定产生的误差。
③用盐酸滴定时,反应后溶液显酸性,因此应该选择甲基橙作指示剂。若盛放盐酸的滴定管在滴定前有气泡未排尽,滴定后无气泡(其他操作均正确),则导致消耗盐酸溶液的体积增加,从而使所测CO2的量会偏大。
④实验测得每1.000g碳酸镁晶须产生的CO2平均值为a mol,依据元素守恒可知,碳酸镁物质的量为amol,根据化学式可知,MgCO3•nH2O中碳酸镁晶体中碳酸镁和结晶水物质的量之比为1:n,得到1:n=a: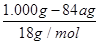 ;得到n=(1-84a)/18a。
;得到n=(1-84a)/18a。
(3)MgCO3•nH2O中n=1~5,分析图象400°C剩余质量为82.3g,为失去结晶水的质量,剩余质量为39.2g是碳酸镁分解失去二氧化碳的质量,得到100g×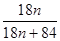 =100-82.3,n=1。
=100-82.3,n=1。
