某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,某研究性学习小组欲分析其成分,实验记录如图所示.
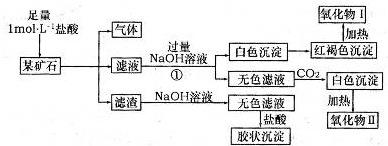
(1)该矿石中含有______(填化学式),请写出实验过程①中反应的离子方程式______.
(2)将氧化物Ⅱ在熔融状态下电解,可以得到某金属单质.当阳极上收集到气体33.6L(已折算成标准状况)时,阴极上得到该金属______g.
(3)试写出该金属与氧化物I反应的化学方程式______;将该反应的产物加入到足量烧碱溶液中,请写出发生反应的离子方程式______.
(4)经进一步分析该矿石中还含有微量的SrCO3(上述方案检测不出).锶(Sr)为第五周期ⅡA族元素.下列叙述正确的是______(填序号).
①氯化锶(SrCl2)溶液显酸性
②SrSO4难溶于水
③工业上可以用电解SrCl2的水溶液制取金属锶(Sr)
④高纯六水氯化锶晶体(SrCl2•6H2O)必须在HCl氛围中加热才能得到SrCl2.
矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,加盐酸生成气体为二氧化碳,则一定含FeCO3;加盐酸后的滤渣为SiO2,胶状沉淀为硅酸;结合转化关系可知,滤液中含氯化亚铁、氯化铝、盐酸,反应①中加足量碱,生成白色沉淀为Fe(OH)2,红褐色沉淀为Fe(OH)3,则氧化物I为Fe2O3;无色滤液中含NaAlO2,通二氧化碳生成的白色沉淀为Al(OH)3,则氧化物II为Al2O3,
(1)由上述分析可知,矿石中含FeCO3、SiO2、Al2O3,①中反应的离子方程式为H++OH-=H2O、Fe2++2OH-=Fe(OH)2↓、Al3++4OH-=AlO2-+2H2O,
故答案为:FeCO3、SiO2、Al2O3;H++OH-=H2O、Fe2++2OH-=Fe(OH)2↓、Al3++4OH-=AlO2-+2H2O;
(2)由4Al~3O2↑可知,阳极上收集到气体33.6L(已折算成标准状况)时,阴极上得到该金属为
×33.6L 22.4L/mol
×27g/mol=54g,故答案为:54;4 3
(3)金属与氧化物I反应的化学方程式为2Al+Fe2O3
Al2O3+2Fe,该反应的产物加入到足量烧碱溶液中,氧化铝与碱反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,高温 .
故答案为:2Al+Fe2O3
Al2O3+2Fe;Al2O3+2OH-=2AlO2-+H2O;高温 .
(4)锶(Sr)为第五周期ⅡA族元素,由同主族元素性质的相似性可知,
①氯化锶(SrCl2)溶液,为强碱强酸盐溶液,显中性,故错误;
②由硫酸钡难溶于水,则SrSO4难溶于水,故正确;
③工业上可以用电解SrCl2的水溶液,金属阳离子不能得到电子,所以不能制取金属锶(Sr),故错误;
④高纯六水氯化锶晶体(SrCl2•6H2O)加热才能得到SrCl2,不存在水解,故错误;
故答案为:②.
