某固体混合物可能含Al、NH4Cl、MgCl2、Al2(SO4)3、FeCl2中的一种或几种,现对该混合物做如下实验.
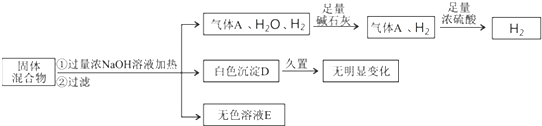
已知气体经过碱石灰和浓硫酸时,二者质量均增大,请回答:
(1)碱石灰的作用是______;气体A是______,生成气体A的离子方程式:______.
(2)写出生成H2的离子方程式是______.
(3)混合物中是否存在FeCl2,理由是______.
(4)白色沉淀D为______(填化学式);固体混合物中不能确定的物质是______(填化学式).
(1)碱石灰具有吸水性,可用于吸收气体中的水蒸气;通过碱石灰干燥后再经过浓硫酸,浓硫酸质量增大,说明生成NH3,铵离子与氢氧根离子加热反应生成氨气,反应的离子方程式为:NH4++OH-
H2O+NH3↑,△ .
故答案为:干燥气体,吸收其中的水蒸气;NH3;NH4++OH-
H2O+NH3↑;△ .
(2)经过浓硫酸后还剩余气体C,则说明生成H2,一定含有Al,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)白色沉淀D久置无颜色变化,说明含有MgCl2,不含有FeCl2,如生成氢氧化亚铁,会迅速变成灰绿色,最终变成红褐色,
故答案为:白色沉淀D 久置颜色无明显变化,说明不存在FeCl2;
(4)含有MgCl2,生成沉淀为Mg(0H)2,实验过程没有涉及Al2(SO4)3的性质及反应现象,不能确定是否含有Al2(SO4)3,
故答案为:Mg(0H)2;Al2(SO4)3.
