问题
计算题
(10分)(1)常温下,将20.0g14%的NaCl溶液与30.0g24%的NaCl溶液混合,混合后得到密度为1.17g/cm3的溶液。请计算:(无解题过程不得分)
①混合后溶液中NaCl的质量分数
②混合后溶液中NaCl的物质的量浓度
③在1000g水中加多少 mol NaCl,才能使其浓度恰好与上述混合后溶液的浓度相等。(结果保留一位小数)
(2)标准状况下,11.2LO2和CO2混合气体的质量为19.6g,求混合气体中O2和CO2的体积之比
答案
(1)①混合过程中溶质是不变的
所以混合后溶液中NaCl的质量分数是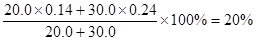
②根据 可知混合后溶液中NaCl的物质的量浓度是
可知混合后溶液中NaCl的物质的量浓度是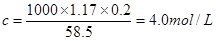
③根据质量分数可知 ,解得x=4.3mol
,解得x=4.3mol
(2)设混合气体中O2和CO2的物质的量分别是x和y
标准状况下,11.2L混合气的物质的量是11.2L÷22.4L/mol=0.5mol
所以有x+y=0.5mol和32x+44y=19.6g
解得x=0.2mol,y=0.3mol
所以混合气体中O2和CO2的体积之比是2:3
考查物质的量有关的计算。
