某同学利用下图所示方法制取一定浓度的双氧水,并且测定其质量分数
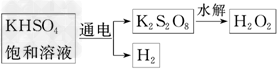
请回答下列问题:
(1)电解KHSO4饱和溶液时,阳极的电极反应式为___________________.
(2)测定所得H2O2溶液的质量分数:
①移取10.00 mL H2O2溶液(密度为1.00 g/mL)至250 mL ________(填仪器名称)中,加水稀释至刻度,摇匀.移取稀释后的H2O2溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样.
②用0.0100 mol/L高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数填写在方框里.
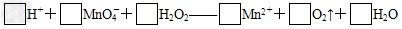
③滴定时,高锰酸钾溶液应装在________.滴定到达终点的现象是__________________________________.
④上述操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率迅速加快.则Mn2+作用的是________________________.
⑤若滴定前俯视读数,滴定后仰视读数,则测定结果________(填“偏高”、“偏低”或“不变”).
⑥用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL.则所得H2O2溶液的质量分数是__________________.
(1)2SO42--2e-===S2O82-
(2)①容量瓶;②6、2、5、2、5、8;③酸式滴定管;滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色;④催化剂;⑤偏高;⑥1.7%
