(12分)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
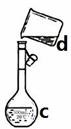
①图中的错误是 。除了图中给出的的仪器和托盘天平外,
为完成实验还需要的仪器有: 。
②根据计算得知,所需NaOH的质量为 。(装置II)
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ______。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,在操作过程中不损失点滴液体,否则会使溶液的浓度偏(高或低)
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀,并转移入试剂瓶中,贴上标签。E.改用 加水,使溶液 。若加水超过刻度线,会造成溶液浓度 应该 。
F.继续往容量瓶内小心加水,直到液面接近刻度 处
(12分) (1)没有用玻璃棒引流。玻璃棒 胶头滴管。
(2) 2.0g (3) BCAFED
A. 低 B. 玻璃棒 C 500
E.胶头滴管, 凹液面的最低点与刻度线相切, 偏小, 重新配制 。
F. 1-2cm
考查一定物质的量浓度溶液的配制及误差分析等。
(1)根据装置图可知,主要的错误是没有用玻璃棒引流,所以还缺少玻璃棒。定容时需要胶头滴管,所以还缺少胶头滴管。
(2)由于没有450ml的容量瓶,所以应该配制500ml容量瓶。则需要氢氧化钠的质量是0.5L×0.1mol/L×40g/mol=2.0g。
(3)根据配制原理可知,正确的操作顺序是BCAFED。
A中如果液体损失,则溶质就减少,所以根据c=n/V可知,浓度是减小的。
B中溶解时需要玻璃棒搅拌加速溶解。
C中所用容量瓶的规格应该是500ml的。
E中定容时需要要胶头滴管滴加,至凹液面的最低点与刻度线相切。加水超过刻度线,则溶液体积偏大,浓度偏小。此时说明实验失败,需要重新配置。
F中当液面接近刻度线1cm~2cm时用胶头滴管定容。

