问题
计算题
(5分)标准状况下,H2和CO的混合气体共8.96L,测得其质量为6.0g,试计算此混合气体中H2和CO的质量和体积各为多少?
答案
0.4g、4.48L;5.6g、4.48L
考查物质的量的有关计算。
根据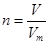 可知混合气的物质的量是
可知混合气的物质的量是
8.96L÷22.4L/mol=0.4mol
n( H2 )×2g/mol+(0.4mol-n( H2 ))×28g/mol="6.0g"
解得 n( H2 )=0.2mol
所以n( CO )=0.4mol-0.2mol=0.2mol
由于n=m/M
所以m( H2 )=0.2mol×2g/mol=0.4g
m( CO )=0.2mol×28g/mol=5.6g
V( CO )=V( H2 )=0.2mol×22.4L/mol=4.48L
