根据下图回答有关问题。
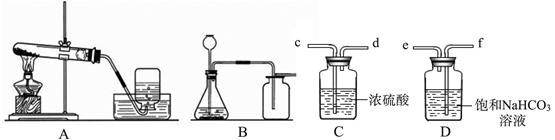
(1)实验室利用A装置制取氧气,当伸入集气瓶的导管口气泡 放出时,才可以收集氧气。
(2)实验室利用B装置制取二氧化碳,该反应的化学方程式是 。制得的二氧化碳中常含有杂质气体,可分别用C、D装置除去, D装置的除杂原理是 (用 化学方程式表示)。
(3)将纯净的二氧化碳气体通入盛有蒸馏水的洗气瓶,一段时间后,测得溶液的pH<7,对该现象的合理解释是 (用化学方程式表示)。
(1)连续均匀
(2)CaCO3 +2HCl=CaCl2 +CO2↑+H2O NaHCO3+HCl=NaCl+CO2↑+H2O
(3)CO2+H2O=H2CO3
题目分析:(1)由于发生装置A的试管中本身存在一定量的空气,故需要排尽试管中的空气后再收集,若用排水法收集氧气,则要等到导管口有气泡连续均匀冒出时,再开始收集。
(2)根据图示,B装置为“固液体不加热型”的发生装置,故适用于固液体在常温下的反应来制取气体;实验室制取二氧化碳,一般选用石灰石或大理石和稀盐酸在常温下反应,生成氯化钙、水和二氧化碳,故反应的方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;
由于盐酸具有挥发性,故收集的二氧化碳气体中会混有一定量的氯化氢气体,为了得到纯净、干燥的二氧化碳气体,需先除去氯化氢气体,再除水,故要先通过饱和碳酸氢钠溶液,再通过浓硫酸,其中碳酸氢钠溶液能与氯化氢反应,生成氯化钠、水和二氧化碳,故反应的化学方程式为NaHCO3 +HCl=NaCl+CO2↑+H2O。
(3)由于二氧化碳能与水反应,生成碳酸,即CO2+H2O=H2CO3,故将纯净的二氧化碳气体通入盛有蒸馏水的洗气瓶,一段时间后,溶液呈酸性,所以测得溶液的pH<7。
点评:熟记氧气和二氧化碳的实验室制法、原理和操作注意事项,是解题的关键;本题考查的重点之一是常用气体的发生装置和收集装置的选取方法,要学会根据反应物的状态和反应的条件选择发生装置,根据制取气体的溶解性和密度的大小选择收集气体的方法。
