如图1是氯碱工业的流程及产物的部分转化关系,其中A、B、C、D、E分别表示一种或多种物质.
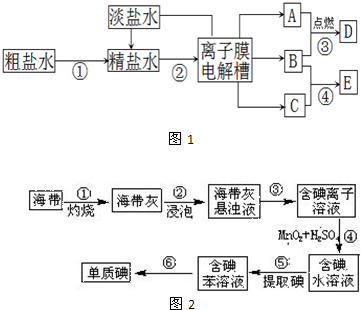
请回答下列问题:
(1)离子膜电解槽中发生反应的化学方程式为:______.
(2)反应④的离子方程式为:______.
(3)粗盐水精制的过程中可能用到①盐酸、②烧碱、③纯碱、④氯化钡、⑤过滤,添加试剂及操作的合理顺序是______(填序号).
(4)碘在工农业生产和日常生活中有重要用途.
(1)图2为海带制碘的流程图.步骤③的实验操作名称是______;步骤④可用Cl2替代MnO2和H2SO4,替代后该步骤发生反应的离子方程式为______.若步骤⑤采用四氯化碳来提取碘,将四氯化碳加入含碘水溶液并振荡,将观察到的现象是______.
(1)根据图示信息,离子膜电解槽中的溶液是食盐水溶液,电解的原理方程式为:2NaCl+2H2O
| ||
| ||
(2)电解氯化钠得到的产物中,氯气和氢氧化钠之间无条件可以发生反应,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)要除去粗盐中含有的杂质,可以加过量的氯化钡溶液除去硫酸镁,加过量的NaOH溶液除去镁离子,加过量的Na2CO3溶液除去氯化钙,通过过滤把不溶于水的物质除去,加适量的盐酸除去过量的氢氧化钠和碳酸钠,为保证杂质全部除去,所加试剂要过量,且碳酸钠放在氯化钡后面加,这样碳酸钠既可以除去杂质还可以除去过量的钡离子,盐酸加在最后,除去氢氧根离子以及过量的碳酸根离子,故答案为:④②③⑤①或④③②⑤①或②④③⑤①;
(4)步骤③是将海带灰悬浊液中的难溶物质和液体分离的方法,实验操作名称是过滤,步骤④可用Cl2替代MnO2和H2SO4,氯气具有氧化性,能将还原性的离子溴离子氧化,替代后该步骤发生反应的离子方程式为:2Br-+Cl2=2Cl-+Br2,将四氯化碳加入含碘水溶液并振荡,碘单质在四氯化碳中的溶解度大于在水中的溶解度,且四氯化碳和水互不相溶,密度比水的大,所以会看到溶液分为两层,上层溶液无色,下层为紫红色,
故答案为:过滤;2Br-+Cl2=2Cl-+Br2;溶液分为两层,上层溶液无色,下层为紫红色.
