问题
计算题
(6分)用31.6g KMnO4氧化密度为1.19g/cm3,溶质质量分数为36.5%的盐酸,反应方程式如下:2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑ + 8H2O
⑴该盐酸的物质的量浓度为 ?
⑵有 mol HCl被氧化?
⑶产生的Cl 2在标准状况下的体积为 ?
答案
(1)11.9mol/L (2)1mol (3)11.2L
考查物质的量的有关计算。
(1)根据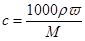 可知,盐酸的浓度是
可知,盐酸的浓度是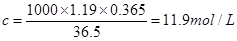 。
。
(2)31.6g KMnO4的物质的量是31.6g÷158g/mol=0.2mol,得到0.2mol×5=1.0mol电子。氯元素的化合价从-1价升高到0价,所以被氧化的盐酸的物质的量是1mol。
(3)根据方程式可知生成氯气的物质的量是0.5mol,所以在标准状况下的体积是0.5mol×22.4L/mol=11.2L。
