柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足得令人惊讶的盐矿资源.液体矿床以钾矿为主,伴生着镁、溴等多种矿产.某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程图1:
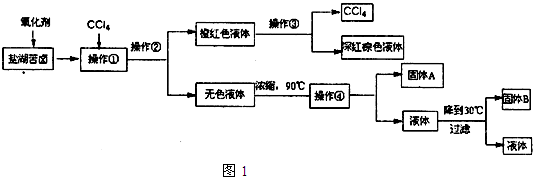
请根据以上流程,回答相关问题:
(1)操作①的名称:______;操作②名称是:______;
操作③的名称是:______;
操作④需要的玻璃仪器有:______.
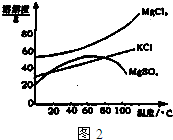
(2)参照图2溶解度曲线,欲得到较纯的氯化钾晶体需用少量的______(选填:“热水”,“冷水”)洗涤固体______(选填“A”或“B”).
(3)同学甲提出一些新的方案,对上述操作②后无色溶液进行除杂提纯,其方案如下:
【有关资料】
| 化学式 | BaCO3 | BaSO4 | Ca(OH)2 | MgCO3 | Mg(OH)2 |
| Ksp | 8.1×10一9 | 1.08×10一10 | 1.0×10一4 | 3.5×10一5 | 1.6×10一11 |
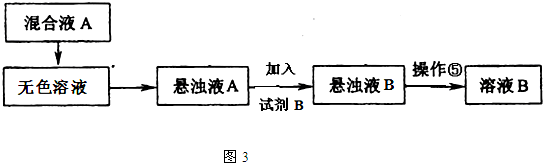
(i)若在图3的操作⑤结束后发现溶液B略有浑浊,应采取的措施是______,
(ii)混合液A的主要成分是______.(填化学式)
【检验除杂效果】
(ⅲ)为检验Mg2+、SO42-是否除尽,通常分别取悬浊液A上层清液于两试管中.进行如下实验:
步骤一:检验Mg2+是否除尽.向其中一支试管中加入______溶液(填化学式),如果没有沉淀生成,则Mg2+已除尽.
步骤二:检验SO42-是否除尽.向另一支试管中加入某溶液,如果无有沉淀生成,则SO42-已除尽,效果最好的是______(填字母).
A.Na2 CO3 B.BaCl2 C.CaCl2
【获取纯净氯化钾】
(ⅳ)对溶液B加热并不断滴加l mol•L一1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C.该操作的目的是______.
(ⅴ)将溶液C倒入______(填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到______时(填现象),停止加热.
【问题讨论】
(ⅵ)进行操作⑤前,需先加热,其目的是______,该操作中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,此时溶解B中Mg2+物质的量浓度为______.
该实验流程是:向富含K+、Mg2+、Br-、SO42-、Cl-的混合物中加入氧化剂,将溴离子氧化为溴单质,再加入四氯化碳萃取剂将混合物中的溴单质提取出来,对于剩余的混合物,加入氢氧化剂和氯化钡将镁离子和硫酸根离子沉淀下来,为保证沉淀干净,所加试剂过量,最后多余的氢氧根离子和碳酸根离子在加入盐酸将之反应掉.
(1)实现溴单质和其他水溶液的分离可以加萃取剂四氯化碳萃取分液,所以操作①的名称是萃取,操作②名称是分液,实现互溶液体溴的四氯化碳溶液的分离采用蒸馏的方法,操作③的名称是蒸馏,操作④是将固体和液体分离的操作即过滤,用到的玻璃仪器有:玻璃棒、漏斗、烧杯,故答案为:萃取;分液;蒸馏;玻璃棒、漏斗、烧杯;
(2)氯化钾的溶解度随温度的升高而增大,所以可以在冷水中较纯的氯化钾晶体,故答案为:冷水,B;
(3)(i)在图3的操作⑤是过滤,实验结束后发现溶液B略有浑浊,应重新过滤,故答案为:更换滤纸,重新过滤;
(ii)在提纯时,加入氢氧化钾、氯化钡可以分别将镁离子以及硫酸根离子除去,除去杂质离子时,为保证除净,加入的试剂是过量的,所以混合液A的主要成分是BaCl2和KOH,故答案为:BaCl2和KOH;
(ⅲ)镁离子可以和氢氧根反应生成氢氧化镁沉淀,所以检验Mg2+是否除尽,可以用氢氧化钾,硫酸根离子可以和钡离子反应生成硫酸钡沉淀,检验硫酸根离子是否除尽,可以用氯化钡,故答案为:KOH;B;
(ⅳ)在提纯时,加入氢氧化钾、氯化钡可以分别将镁离子以及硫酸根离子除去,除去杂质离子时,为保证除净,加入的试剂是过量的,最后加盐酸可以除去多余的碳酸根和氢氧根,
故答案为:加盐酸调节至pH=5目的是除去未反应的OH-和CO32-;
(ⅴ)根据蒸发结晶实验的原则:在蒸发皿中,当出现较多晶体,剩余较少水时,停止加热,用余热蒸干,故答案为:蒸发皿;出现较多晶体,剩余较少水时;
(ⅵ)为保证沉淀的彻底,要将混合物加热,使沉淀颗粒增大,根据Ksp=[Mg2+][OH-]2,则溶解B中Mg2+物质的量浓度c=
=Ksp [OH]2
=1.6×10一7mol/L,故答案为:使沉淀颗粒增大,便于过滤;1.6×10-7mol/L.1.6×10-11 (10-2)2
