问题
选择题
由CO、H2和O2组成的混合气体60ml,在一定条件下恰好完全反应,测得生成物在101KPa、120°C下对空气的相对密度为1.293,则原混合气体中H2所占的体积分数为
A.
B.
C.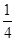
D.
答案
答案:A
设原混合气中CO、H2和O2的物质的量分别是x、y、z,则生成的CO2和水蒸气分别是x和y。生成物在101KPa、120°C下对空气的相对密度为1.293,所以生成物的平均相对分子质量是29×1.293=37.5。所以CO2和水蒸气的物质的量之比是(37.5-18)÷(44-37.5)=3︰1。又因为0.5x+0.5y=z,所以y÷(x+y+z)=1/6,答案选A。
