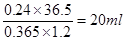问题
计算题
(8分)将7.8g锌投入100mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:
(1)反应中生成的H2在标准状况下的体积。
(2)所用盐酸中HCl的物质的量浓度。
(3)需用多少体积的36.5%的浓盐酸(ρ =1.2g/mL)来配置上述盐酸
答案
(6分)(1)2.688L (2) 2.4 mol / L (3)20mL
考查物质的量的有关计算。
(1)7.8g锌的物质的量是7.8g÷65g/mol=0.12mol
反应的方程式是
Zn+2HCl=ZnCl2+H2↑
1 2 1
0.12mol
则生成氢气是0.12mol
标准状况下的体积是0.12mol×22.4L/mol=2.688L
(2)参加反应的氯化氢是0.12mol×2=0.24mol
所以所用盐酸中HCl的物质的量浓度是
0.24mol÷0.1L=2.4mol/L
(3)根据盐酸的质量分数和溶液的密度可知,需要盐酸的体积是