溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:
NaBr+H2SO4→NaHSO4+HBr
CH3CH2OH+HBr
CH3CH2Br+H2O硫酸
某课外小组欲在实验室制备溴乙烷的装置如图.数据如表.
| 物质 数据 | 乙醇 | 溴乙烷 | 1,2-二溴乙烷 | 乙醚 | 浓硫酸 |
| 密度/g•cm-3 | 0.79 | 1.46 | 2.2 | 0.71 | 1.84 |
| 熔点(℃) | -130 | -119 | 9 | -116 | 10 |
| 沸点(℃) | 78.5 | 38.4 | 132 | 34.6 | 338 |
| 在水中的溶解度(g/100g水) | 互溶 | 0.914 | 1 | 7.5 | 互溶 |
(1)加入药品之前须做的操作是:______,实验进行的途中若发现未加入碎瓷片,其处理的方法是______.
(2)装置B的作用是除了使溴乙烷馏出,还有一个目的是______.温度计的温度应控制在______之间.
(3)反应时有可能生成SO2和一种红棕色气体,可选择氢氧化钠溶液除去该气体,有关的离子方程式是______,______,此操作可在______(填写玻璃仪器名称)中进行,同时进行分离.
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应,另一方面是为了______.
(5)粗产品中含有的主要有机液体杂质是______,为进一步制得纯净的溴乙烷,对粗产品进行水洗涤、分液,再加入无水CaCl2,进行______操作.
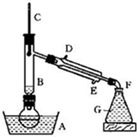
(1)实验室制备溴乙烷,用95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末为原料,反应中有气体生成,且乙醇易挥发,所以在加入药品之前应进行的操作是:检查装置的气密性;碎瓷片能防止液体爆沸,实验进行的途中若发现未加入碎瓷片,不能再进行继续实验,也不能立即加入碎瓷片,需冷却后重新进行操作,
故答案为:检查装置的气密性;待冷却后重新进行操作;
(2)装置B的作用使乙醇蒸气回流到烧瓶中继续反应,溴乙烷的沸点为38.4℃,乙醇的沸点为78.5℃,让溴乙烷蒸发出,让乙醇冷凝回流,所以温度计的温度应控制在38.4℃~78.5℃,
故答案为:冷凝回流;38.4℃~78.5℃;
(3)二氧化硫与氢氧化钠溶液反应生成亚硫酸钠和水,反应的化学方程式是:SO2+2NaOH═Na2SO3+H2O,离子反应为:SO2+2OH-=SO32-+H2O,溴能和氢氧化钠反应:Br2+2NaOH═NaBr+NaBrO+H2O,离子反应为:Br2+2OH-=Br-+BrO-+H2O,分离不互溶的有机物和无机物,用分液漏斗进行操作,
故答案为:SO2+2OH-=SO32-+H2O;Br2+2OH-=Br-+BrO-+H2O;分液漏斗;
(4)浓硫酸具有强氧化性,能氧化溴化氢,同时浓硫酸溶于水,放出大量的热,促进溴化氢气体的挥发,所以实验中采用浓度较低的80%硫酸,
故答案为:防止溴化氢气体的挥发;
(5)乙醇在浓硫酸的作用下发生分子间脱水,生成乙醚,所以溴乙烷中含有副产物乙醚,乙醚和溴乙烷为互溶的有机物,可利用它们的沸点不同,进行蒸馏分离,
故答案为:乙醚;蒸馏;
