某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
【实验设计】方法:按照下图进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行。
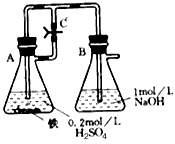
(1)最终在_______容器中观察到白色沉淀,该实验中涉及到的化学方程式有:____________________________ 。
【探究思考】实验表明上述实验中出现白色的沉淀会逐渐转变为灰绿色或绿色,那么如何解释出现灰绿色或绿色的现象呢?
(2)甲同学查阅资料后,得到Fe(OH)2如下信息:
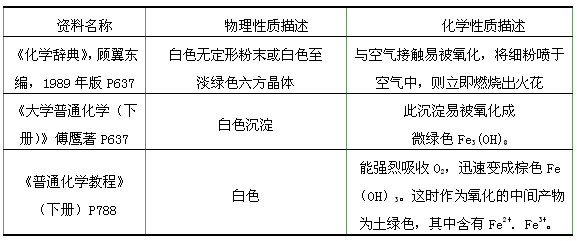
阅读该资料后,你对上述实验中出现灰绿色或绿色的现象的解释是:__________ ;资料中提及的微绿色Fe3(OH)8,用氧化物的形式表示可写成__________________。
(3)乙同学依据配色原理:白色和棕色不可能调配成绿色或灰绿色的常识,认为绿色可能是形成Fe(OH)2·nH2O所致。用热水浴的方式加热“方法一”中生成的绿色沉淀,观察到沉淀由绿变白的趋势。加热时,“方法一”中弹簧夹C应处于___________(填“打开”或“关闭”)状态,容器A中的反应须处于___________(填“停止”或“发生”)状态。写出该实验中支持乙同学观点的化学方程式_______________。
(4)欢迎你参加该研究小组的讨论,请提出一种在研究由Fe2+制备Fe(OH)2的过程中,有助于对沉淀由“白”变“绿”的现象进行合理解释的实验设计新思路。___________________________________ 。
(1)B;Fe+H2SO4=FeSO4+H2↑.FeSO4+2NaOH=Fe(OH)2↓+Na2SO4.H2SO4+2NaOH=Na2SO4+2H2O (中和反应方程式不写不扣分)
(2)由于Fe(OH)2部分被氧化,混入少量的Fe(OH)3;FeO·Fe2O3·4H2O
(3)打开;发生;Fe(OH)2·nH2O= Fe(OH)2+ nH2O
(4)向Fe2+和Fe3+的混合液中加入NaOH溶液后,观察生成的沉淀的颜色是否为灰绿色(或者可以将Fe(OH)3和Fe(OH)2混合后观察其颜色。)
