(本题共12分)
氯气和氯乙烯都是重要的化工产品,年产量均在107t左右。氯气的实验室制备和氯乙烯的工业生产都有多种不同方法。
完成下列填空:
(1)实验室制取纯净的氯气,除了二氧化锰、浓盐酸和浓硫酸,还需要_________、________(填写试剂或溶液名称)
(2)实验室用2.00mol/L的盐酸和漂粉精[成分为Ca(ClO)2、CaCl2]反应生成氯气、氯化钙和水,若产生2.24L(标准状况)氯气,发生反应的盐酸为_________m,l。
(3)实验室通常用向上排空气法收集氯气。设计一个简单实验,验证所收集的氯气中是否含有空气。
_________________
4)工业上用电石-乙炔法生产乙烯的反应如下:
CaO+3C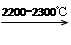 CaC2+CO
CaC2+CO
CaC2+2H2O→HC≡CH↑+Ca(OH)2
HC≡CH↑+HCl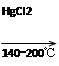 CH2=CHCl
CH2=CHCl
电石-乙炔法的优点是流程简单,产品纯度高,而且不依赖于石油资源。
电石-乙炔法的缺点是___________________、_____________________。
(5)乙烷和氯气反应可制得ClCH2CH2Cl,ClCH2CH2Cl加热分解得到氯乙烯和氯化氢。设计一种以乙烯和氯气为原料制取氯乙烯的方案(其他原料自选),用化学方程式表示(不必注明反应条件)。
要求:①反应产生的氯化氢必须用于氯乙烯的制备;②不再产生其他废液。
___________________________________
(1)饱和氯化钠溶液、氢氧化钠溶液 (2)100
(3)用试管收集氯气,收集满后讲试管倒立在氢氧化钠溶液中,观察试管内有无残留气体。
(4)高能耗 会污染环境
(5)CH2=CH2+Cl2→ClCH2CH2Cl ClCH2CH2Cl→CH2=CHCl+HCl HC≡CH+HCl→CH2=CHCl
题目分析:(1)浓盐酸易挥发,生成的氯气中含有氯化氢,应该用饱和氯化钠溶液除去;氯气有毒需要尾气处理,用氢氧化钠溶液吸收。
(2)根据反应物和生成物可知,反应的化学方程式为4HCl+Ca(ClO)2→CaCl2+2H2O+2Cl2↑,反应中生成氯气的物质的量是0.1mol,则消耗氯化氢的物质的量是0.2mol,盐酸的浓度是2.00mol/L,因此需要盐酸的溶液的体积是100ml。
(3)氯气能与氢氧化钠溶液完全反应,而空气与氢氧化钠不反应,据此检验,即试管收集氯气,收集满后讲试管倒立在氢氧化钠溶液中,观察试管内有无残留气体。
(4)根据流程可知,反应需要高温,因此缺点之一是高能耗;需要氯化汞作催化剂,汞是重金属,因此缺点之二是会污染环境。
(5)乙烷和氯气反应可制得ClCH2CH2Cl,ClCH2CH2Cl加热分解得到氯乙烯和氯化氢,产生的氯化氢可以与乙炔反应又生成氯乙烯,因此方案为CH2=CH2+Cl2→ClCH2CH2Cl、ClCH2CH2Cl→CH2=CHCl+HCl、HC≡CH+HCl→CH2=CHCl。
