欲用98%的浓硫酸(g=1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸500ml。
(1)选用的仪器有:
①量筒 ②烧杯 ③玻璃棒④____________,⑤____________。
(2)下列各操作正确的顺序为____________________________。
A.用量筒量取浓H2SO4
B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至刻度线
D.洗涤所用仪器2至3次,洗涤液也转入容量瓶中E.稀释浓H2SO4
F.将溶液转入容量瓶
(3)简要回答下列问题:
①所需浓硫酸的体积为____________mL。
②浓硫酸稀释后在转入容量瓶前应____________,否则会使浓度偏____________。
③定容时必须使溶液液面与刻度线相切,若俯视会使浓度偏___________。
(8分)(1)500mL容量瓶 胶头滴管 (每空1分)
(2)A、E、F、D、C、B (2分)
(3)①13.6 (1分)
②恢复至室温(1分) 高(1分)
③高(1分)
考查一定物质的量浓度溶液的配制以及有关误差分析等。
(1)配制500ml稀硫酸,则需要500ml容量瓶,定容时还需要胶头滴管。
(2)根据配制原理及实验要求可知,正确的操作顺序是A、E、F、D、C、B。
(1)①由于在稀释过程中溶质是不变的,所以需要浓硫酸的体积是
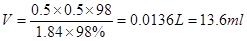 。
。
②由于浓硫酸溶于水放出大量的热,所以在转移至容量瓶之前需要恢复至室温。如果不冷却即转移,则根据热胀冷缩可知,容量瓶中溶液的体积偏少,因此浓度偏高。
③根据c=n/V可知,若定容时俯视刻度线,则容量瓶中溶液的体积减少,浓度偏高。
