某结晶水合物含有两种阳离子和一种阴离子.称取两份质量均为45.3 g的该结晶水合物,分别制成溶液.向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24 L该气体(标准状况);最后白色沉淀逐渐减少并最终消失.另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g.
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是________和________,阴离子是________.
(2)该结晶水合物的化__________________________________________________.
(3)假设过程中向该溶液中加入的NaOH溶液的物质的量浓度为5 mol·L-1,请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图.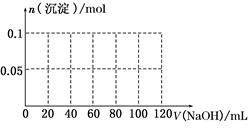
】(1) NH4+ 、Al3+ 、SO42-
(2)NH4Al(SO4)2·12H2O[或(NH4)2SO4·Al2(SO4)3·24H2O]
(3)

(1)能使湿润红色石蕊试纸变蓝的气体是NH3,则水合物中有NH4+。加入NaOH溶液,先出现沉淀,后沉淀消失,则水合物中有Al3+.加入Ba(OH)2先出现沉淀,后沉淀溶解,溶解不完.没有溶解的沉淀不溶于HNO3说明含SO42-。
(2)n(SO42-)=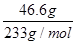 =0.2 mol
=0.2 mol
n(NH4+)= =0.1 mol
=0.1 mol
根据离子化合物中阴、阳离子电荷平衡的原理:n(NH4+)+3n(Al3+)=2n(SO42-)可得:
n(Al3+)= (2×0.2 mol-0.1 mol)=0.1 mol
(2×0.2 mol-0.1 mol)=0.1 mol
n(H2O)=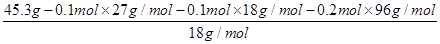 =1.2 mol
=1.2 mol
该结晶水合物的化学式为NH4 Al(SO4)2·12H2O[或(NH4)2SO4·Al2(SO4)3·24H2O]
(3)Al3+完全沉淀消耗V(NaOH)=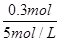 =0.060 L=60 mL
=0.060 L=60 mL
NH4+转化为NH3·H2O消耗V(NaOH)=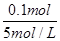 =0.020 L=20 mL
=0.020 L=20 mL
Al(OH)3完全溶解消耗V(NaOH)=20 moL。
