(本题16分)Ⅰ.实验室经常要制取某种气体并验证该气体的性质。
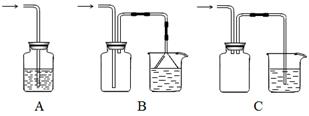
(1)下列装置适合作尾气吸收的是 (填序号)。
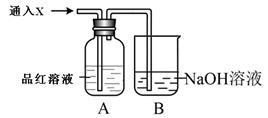
(2)向下列装置中通入气体X,A中品红溶液褪色,则X可能是___________(至少填两种)如果要证明X是SO2气体,接下来的操作是:________________________________
Ⅱ.实验室用FeSO4溶液和NaOH溶液反应制取Fe(OH)2,却很难看到稳定的白色沉淀。有同学设计了一种新的实验方法,能清楚看到生成白色沉淀及白色沉淀转化成红褐色沉淀的现象。请完成以下空白:
(1)取一定体积的0.1mol.L-1NaOH溶液放于烧杯中,_________后,再滴入几滴植物油;
(2)选择装置___________(填“甲”或“乙”),将(1)所得溶液加入到装置中并按图示组装好装置。
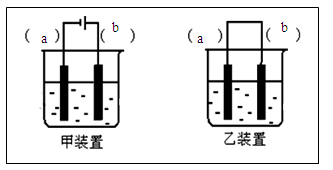
(3)在你选择的装置上标明电极材料分别为____________、________________
(4)实验中可在___________看到稳定的白色Fe(OH)2沉淀。
(5)如果要看到白色沉淀转化为红褐色沉淀的的现象,接下来的操作是______________
Ⅰ.(1)BC(2分)
(2)SO2、Cl2(O3、ClO2等)(2分)将褪色后的溶液再加热,如果溶液又恢复成红色,则X一定为SO2(2分)
Ⅱ.(1)加热煮沸(2分)
(2)装置甲 (2分)
(3)b-Fe (1分) a-石墨(Fe) (1分)
(4)阳极附近溶液中 (2分)
(5)将电极反向连接 (2分)
题目分析:
Ⅰ.(1)本题答题要从防止倒吸的角度去想。
(2)能使品红褪色的可马上想到SO2,再细想一下还有Cl2、O3、ClO2,如果要证明通入的是二氧化硫,则要用试管取褪色后的溶液,用酒精灯进行加热,看是否能恢复颜色;本题答题时一定要有操作、现象、结论
Ⅱ.本题要注意目的为了制备Fe(OH)2,观察其颜色,所以关键是所用的试剂要除O2,装置要隔绝空气,(1)溶液要除氧气则用加热煮沸的方法,温度升高,气体在水是的溶解度下降(2)甲和乙装置的区别在于有无外接电源,做这种题是二选一的情况,可以用假设选用一装置,代入题意;从本题的角度,可知要产生二价铁离子,再和氢氧根离子反应,所以要选用电解池,即甲装置;b电极为阳极产生二价铁离子则为Fe,a电极为石墨;因为阳极上产生二价铁离子,所以白色沉淀在阳极的附近可观察到,如果要想白色沉淀转化为红褐色沉淀,则要加入氧化剂,从题意中不能加入,但如果将电极反接,相当于用惰性电极电解氢氧化钠溶液,即电解水,氧气就可产生了,也就实现了转化。
