(12分)Na2S2O3(俗称保险粉)在医药、印染中应用广泛,可通过下列方法制备:取15.1 gNa2SO3溶于80.0 mL水。另取5.0 g硫粉,用少许乙醇润湿后加到上述溶液中。小火加热至微沸,反应1小时后过滤。滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3·5H2O。
(1)加入的硫粉用乙醇润湿的目的是 。
(2)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机化合物杂质是 ;其检测的方法是:取出少许溶液,加盐酸至酸性后,过滤除去S,再加BaCl2溶液。则加入的盐酸发生两个反应的化学方程式为:
Na2SO3+2HCl=SO2↑+H2O+2NaCl; 。
(3)某环境监测小组用含0.100 mol·L-1Na2S2O3溶液[含少量的Na2SO3,且n(Na2S2O3) ∶n(Na2SO3)
= 5∶1]测定某工厂废水中Ba2+的浓度。他们取废水50.0 mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀硫酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,用上述Na2S2O3溶液进行滴定,反应完全时,测得消耗Na2S2O3溶液的体积为36.0 mL。
(已知有关反应的离子方程式为:①Cr2O72-+6I-+14H+ 2Cr3++3I2+7H2O;
②I2+2S2O32- 2I-+S4O62-;③I2+SO32-+H2O 2I-+SO42-+2H+)
则滴定过程中可用 作指示剂。计算该工厂废水中Ba2+的物质的量浓度。
共12分。
(1)有利于硫粉和Na2SO3溶液充分接触,加快反应速率(2分)
(2)Na2SO4(1分) Na2S2O3+2HCl=S↓+SO2↑+H2O+2NaCl(2分)
(3)淀粉(1分)
n(Na2S2O3) =" 0.0360" L×0.100 mol·L-1 =" 0.0036" mol
则n(Na2SO3) =" 0.00360" mol÷5 =" 0.00072" mol
根据题意:2BaCrO4 ~ Cr2O72- ~ 3I2 ~ 6S2O32-
得n1(BaCrO4) = 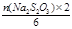 =
=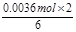 =" 0.0012" mol
=" 0.0012" mol
2BaCrO4 ~ Cr2O72- ~ 3I2 ~ 3SO32-
得n2(BaCrO4) = 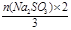 =
=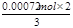 =" 0.00048" mol
=" 0.00048" mol
则c(Ba2+) = 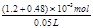 = 3.36×10-2 mol·L-1(6分)
= 3.36×10-2 mol·L-1(6分)
题目分析:(1)硫易溶于有机溶剂,乙醇易溶于水,所以用乙醇润湿硫粉,目的是增大其与水的接触面积,有利于与Na2SO3溶液充分接触,加快反应速率;
(2)亚硫酸钠在加热的过程中可能被氧化而生成硫酸钠,所以最可能存在的无机化合物杂质是Na2SO4;硫酸钠 氯化钡溶液检验,亚硫酸钠与元素反应知产生二氧化硫气体,而Na2S2O3与盐酸反应既有二氧化硫生成,又有硫单质生成,所以根据现象的不同可以检测,盐酸的另一作用的化学方程式为Na2S2O3+2HCl=S↓+SO2↑+H2O+2NaCl;
(3)Na2S2O3溶液进行滴定的是碘单质,所以选用淀粉作指示剂,碘与淀粉的混合液为蓝色,滴定终点时蓝色消失;根据Na2S2O3溶液的体积可计算碘单质的物质的量,从而可计算BaCrO4沉淀的物质的量,也就可以计算钡离子的浓度,根据方程式得出关系式,具体步骤见答案。
