(9分)某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发。为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验。请回答相关问题。
(1)为了探究SO2能否使品红褪色,该同学选择了正确的药品后,设计了如下图所示实验装置,请指出实验装置图设计中的不合理之处。
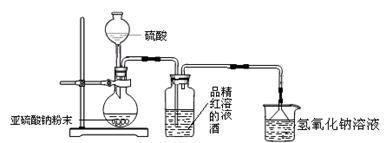
① ;
② 。
(2)该同学选择了正确装置后,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色。为此,你认为使品红的水溶液褪色的微粒可能是 。
(3)该同学进一步实验如下:取等量相同浓度的品红水溶液于两支试管中,再分别加入少量亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,他得出结论:使品红褪色的微粒肯定是HSO3-或SO32-。你认为他的结论是否正确 , 其理由是 。
(4)再用以下装置探究SO2的某些化学性质。
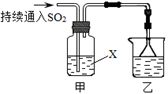
①装置乙的作用是 。
②若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有 。
a.氧化性 b.还原性
c.漂白性 d.不稳定性
③若试剂X为Ca(ClO)2溶液,可观察到白色沉淀生成,完成该过程的离子方程式:
 Ca2++
Ca2++ ClO-+
ClO-+ SO2+
SO2+ H2O=
H2O= ↓+
↓+ Cl-+
Cl-+ SO42-+
SO42-+ 。
。
(1)①缺少二氧化硫的干燥装置(1分); ②不能使用长颈漏斗(1分)
(2) H2SO3、HSO3-、SO32-(1分)
(3)不正确(1分) 因为亚硫酸根离子和亚硫酸氢根离子都会水解生成亚硫酸(1分)。
(4)①尾气处理;(1分)②a;(1分)
③Ca2++2ClO-+2SO2+2H2O=CaSO4↓+2Cl-+SO42-+4H+.(2分)
题目分析:(1)该同学的实验目的是为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,所以二氧化硫必须是干燥的,缺少干燥装置;其次不能用长颈漏斗盛放硫酸,应该用分液漏斗;
(2)二氧化硫通过品红的酒精溶液,溶液不褪色,而通过品红的水溶液褪色,二氧化硫通入酒精溶液与二氧化硫的水溶液中不同的粒子主要有H2SO3、HSO3-、SO32-,这些粒子都可能是使品红褪色的粒子;
(3)亚硫酸钠固体和亚硫酸氢钠固体溶于水后,水解都得到H2SO3,所以不能判断是使品红褪色的微粒肯定是HSO3-或SO32-。该同学的判断是不正确的;
(4)①装置乙用于吸收剩余的二氧化硫,防止污染空气;
②Na2S与二氧化硫反应生成S单质,二氧化硫中的S元素的化合价降低,说明二氧化硫具有氧化性,答案选a;
③Ca(ClO)2溶液与二氧化硫发生氧化还原反应,剩余该方程式中的沉淀是CaSO4,根据元素守恒,判断另一物质是H+,SO2中S元素化合价升高2价,Ca(ClO)2中Cl元素整体降低2价,所以方程式中SO2与Ca(ClO)2的系数均是1,根据电荷守恒和观察法配平其他物质的系数,离子方程式为Ca2++2ClO-+2SO2+2H2O=CaSO4↓+2Cl-+SO42-+4H+.
