乙酸乙酯是无色具有水果香味的液体,沸点为77.2 ℃,实验室某次制取它用冰醋酸14.3 mL、95%乙醇 23 mL。还用到浓硫酸、饱和碳酸钠以及极易与乙醇结合成六水合物的氯化钙溶液。主要装置如图所示:
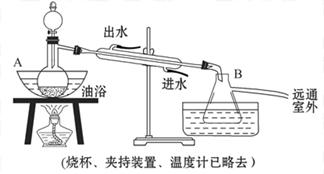
实验步骤:
①先向A中的蒸馏烧瓶中注入少量乙醇和浓硫酸后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗里待用。这时分液漏斗里冰醋酸和乙醇的物质的量之比约为5∶7。
②加热油浴保温约135 ℃~145℃
③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加入速率使蒸出酯的速率与进料速率大体相等,直到加料完成。
④保持油浴温度一段时间,至不再有液体馏出后,停止加热。
⑤取下B中的锥形瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边振荡,至无气泡产生为止。
⑥将⑤的液体混合物分液,弃去水层。
⑦将饱和CaCl2溶液(适量)加入到分液漏斗中,振荡一段时间后静置,放出水层(废液)。
⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品。
试回答:
(1)实验中浓硫酸的主要作用是__________ _______。
(2)用过量乙醇的主要目的是________ _________。
(3)用饱和Na2CO3溶液洗涤粗酯的目的是________ ___。
如果用NaOH溶液代替Na2CO3溶液将引起的后果___________________________________。
(4)用饱和CaCl2溶液洗涤粗酯的目的是_____ ______。
(5)在步骤⑧所得的粗酯里还含有的杂质是______ ___。
(1)作催化剂和吸水剂
(2)使酯化反应向生成乙酸乙酯的方向移动,提高乙酸乙酯的产率
(3)除去乙酸
使乙酸乙酯水解而使实验失败
(4)除去乙醇
(5)水
题目分析:在乙酸乙酯的反应中,浓硫酸做催化剂和脱水剂。根据勒沙特列原理,增加乙醇可以使反应向生产乙酸乙酯的方向移动,从而提高乙酸乙酯的产率。在这个试验中。饱和碳酸钠的作用主要有三个1.溶解乙醇。2.中和乙酸.3.降低乙酸乙酯的溶解。如果用氢氧化钠取代碳酸钠,则乙酸乙酯在碱性条件下会发生水解,造成收集不到乙酸乙酯,实验失败。乙酸与乙醇反应生成乙酸乙酯和水
